Пренатальная диагностика связана с решением ряда биологических и этических проблем до рождения ребенка, так как при этом речь идет не об излечении болезни, а о предупреждении рождения ребенка с патологией, не поддающейся лечению (обычно путем прерывания беременности с согласия женщины). При современном уровне развития пренатальной диагностики можно установить диагноз всех хромосомных болезней, большинства врожденных пороков развития, энзимопатий, при которых известен биохимический дефект. Часть из них можно установить практически в любом сроке беременности (хромосомные болезни), часть - после 12-й недели (редукционные пороки конечностей, атрезии, анэнцефалию), часть - только во второй половине беременности (пороки сердца, почек).
Показания для пренатальной диагностики: наличие в семье точно установленного наследственного заболевания; возраст матери старше 37 лет; носительство матерью гена Х-сцепленного рецессивного заболевания; наличие в анамнезе у беременных спонтанных абортов в ранние сроки беременности, мертворождений неясного генеза, детей с множественными пороками развития и с хромосомной патологией; наличие структурных перестроек хромосом (особенно транслокаций и инверсий) у одного из родителей; гетерозиготность обоих родителей по одной паре аллелей при патологии с аутосомно-рецессивным типом наследования; беременные из зоны повышенного радиационного фона.
В настоящее время применяются непрямые и прямые методы пренатальной диагностики .
При непрямых методах обследуют беременную (акушерско-гинекологические методы, сыворотка крови на альфа-фетопротеин); при прямых - плод.
К прямым неинвазивным (без хирургического вмешательства) методам относится ультрасонография ; ЯМР-томография плода,
к прямым инвазивным (с нарушением целостности тканей) относятся: хорионбиопсия, амниоцентез, кордоцентез и фетоскопия.
Ультрасонография (эхография) - это использование ультразвука для получения изображения плода и его оболочек, состояния плаценты. Начиная с 5-й недели беременности можно получить изображение оболочек эмбриона, а с 7-й недели - и его самого. К концу 6-й недели беременности можно зарегистрировать сердечную деятельность эмбриона. В первые два месяца беременности ультразвуковое исследование еще не позволяет выявить аномалии развития плода, но можно определить его жизнеспособность. Во 2-м триместре беременности возможности ультразвуковой диагностики значительно возрастают. На 12- 20-й неделе беременности уже возможна диагностика близнецовой беременности, локализации плаценты, анэнцефалии, дефектов костной системы и закрытия невральной трубки, атрезии желудочно-кишечного тракта.
В последние годы получает распространение ЯМР-томография плода, позволяющая выявить структурные аномалии, не обнаруживаемые при УЗИ (малые аномалии мозга, туберозный склероз, поликистоз почек и др.).
Прямые инвазивные методы пренатальной диагностики
Хорионбиопсия - взятие эпителия ворсинок хориона для исследования - проводится трансцервикально (через канал шейки матки) или трансабдоминально под контролем ультрасонографии между 8-й и 10-й неделями гестации. Полученная ткань используется для цитогенетических и биохимических исследований и анализа ДНК. С помощью этого метода можно выявлять все виды мутаций (генные, хромосомные и геномные). Значительным преимуществом биопсии ворсин хориона является то, что этот метод пренатальной диагностики может быть использован уже на ранних этапах развития плода. Если выявляются какие-либо отклонения в развитии плода и родители решают прервать беременность, то прерывание беременности на 12-й неделе (срок проведения биопсии ворсин хориона) менее опасно, чем на 18-20-й неделе, когда становятся известны результаты амниоцентеза
Амниоцентез - получение амниотической жидкости и клеток плода для последующего анализа. Это исследование стало возможным после того, как была разработана технология трансабдоминального или трансвагинального амниоцентеза, проводимого под контролем УЗИ. Получение исследуемого материала (клетки и жидкость) возможно на 16-й неделе беременности. Основные показания для амниоцентеза:
1) возраст беременной более 35 лет;
2) превышение пороговых значений уровней альфа-фетопротеина, хорионичеокого гонадотропина и снижение свободного эстриола в крови беременной:
3) наличие нескольких серьезных факторов риска осложнений беременности;
Кордоцентез - взятие крови из пуповины , клетки и сыворотка которой используются для цитогенетических, молекуляр-но-генетических и биохимических исследований. Эта процедура проводится в срок с 18-й по 22-ю неделю беременности под контролем УЗ И. Кордоцентез может быть осуществлен также при проведении эмбриофетоскопии. Процедура успешна с первой попытки в 80-97% случаев. Преимущество кордоцентеза по сравнению с амниоцентезом заключается в том, что лимфоциты культивируются значительно быстрее и надежнее, чем амниоциты. Например, определение вирусоспецифической ДНК или РНК (методом обратной транскрипции) в крови плода имеет решающее значение для диагностики внутриутробных инфекций - ВИЧ, краснухи, цитомегалии, парвовируса В19. Однако показания для проведения кордоцентеза ограничены в связи с высоким риском осложнений, таких как внутриутробная гибель плода (до 6%), недонашивание беременности (9%).
Фетоскопия - осмотр плода фиброоптическим эндоскопом, введенным в амниотическую полость через переднюю стенку матки . Метод позволяет осмотреть плод, пуповину, плаценту и произвести биопсию. Фетоскопия сопровождается высоким риском прерывания беременности и технически сложна, поэтому имеет ограниченное применение.
Современные технологиипозволяют осуществлятьбиопсию кожи, мышц, печени плода для диагностики генодерматозов, мышечных дистрофий, гликогенозов и других тяжелых наследственных заболеваний. Риск прерывания беременности при применении инвазивных методов пренатальной диагностики составляет 1-2%.
Везикоцентез , или пункция мочевого пузыря плода , используется для получения его мочи для исследования в случаях серьезных заболеваний и пороков развития органов мочевой системы.
Доимплантационная диагностика
серьезных наследственных болезней стала возможной в последнее десятилетие благодаря разработке технологии экстракорпорального оплодотворения и использования полимеразной цепной реакции (ПЦР ) для получения множественных копий эмбриональной ДНК. На стадии дробления оплодотворенной яйцеклетки (бластоцисты), когда зародыш состоит из 6-8 отдельных клеток, методами микроманипуляции отделяется одна из них для выделения ДНК, ее мультипликации и последующего анализа с помощью ДНК-зондов (праймерная полимеразная цепная реакция, Sauthern-blot, исследование полиморфизма рестрикционных фрагментов ДНК и др. ). Эта технология применена для выявления наследственных болезней - Тея-Сакса, гемофилии, миодистрофии Дюшенна, фрагильной Х-хромосомы и ряда других. Однако она доступна немногим крупным центрам и отличается очень высокой стоимостью исследования.
Разрабатываются методы выделения клеток плода (эритробластов, трофобластов и др.), циркулирующих в крови беременной , для проведения цитогенетических, молекулярно-генетических и иммунологических анализов в диагностических целях. Пока такая диагностика возможна лишь в тех случаях, когда в клетках крови (эритробластах) беременной имеются хромосомы или гены плода, например Y-хромосома, ген резус-фактора у резус-отрицательной женщины, антигены системы HLA, унаследованные от отца.
Дальнейшее развитие и распространение методов пренатальной диагностики наследственных заболеваний позволят значительно снизить частоту наследственной патологии новорожденных.
В настоящее время большое внимание уделяется антенатальному периоду развития плода. Своевременная диагностика нарушений жизнедеятельности плода и правильная пренатальная профилактика являются важными факторами снижения перинатальной смертности и осложнений неонатального периода.
Пренатальная диагностика - это комплекс методов получения информации о плоде.
История пренатальной диагностики исчисляется с 1818 г., когда швейцарский врач Мейер, проводя осмотр беременной, впервые выслышал сердечные тоны плода обычным терапевтическим стетоскопом. Однако первое официальное сообщение о возможности выслушивания сердцебиения и двигательной активности плода было сделано только через четыре года французским врачом Керджерадом в Парижской медицинской академии.
В 1827 г. в Дублине ирландский врач Джон Фергюсон представил технику выслушивания сердцебиения плода стетоскопом. А в 1833 г. Эвори Кеннеди опубликовал монографию «Аускультативные наблюдения в акушерстве», где он определил критерии ЧСС здорового плода (от 100 до 160 уд/мин), которые до сих пор используются в акушерстве.
На Х Международном медицинском конгрессе в 1891 г. впервые представлена фонокардиограмма (ФКГ) плода, а в 1906 г. немецкий исследователь Кремер продемонстрировал первую ЭКГ плода, снятую при помощи абдоминального и влагалищного электродов. Это сообщение было воспринято как интересный казуистический случай, и на определенный промежуток времени о нем забыли. Только с начала 1950-х годов ФКГ и ЭКГ плода получили широкое распространение. Однако данные методы имели ряд существенных недостатков. Так, при проведении прямой ЭКГ один электрод необходимо вводить толстой пункционной иглой через брюшную стенку и закреплять на ягодице плода. Инвазивность метода снизила его популярность. При проведении непрямой ЭКГ, при которой электроды закрепляются на передней брюшной стенке, невозможно записать зубец Р и, следовательно, определить различные виды нарушения атриовентрикулярной проводимости. В настоя-
щее время с появлением более информативных и неинвазивных методов исследования плода использование ЭКГ и ФКГ ограничено.
С середины 1950-х годов широкое распространение получает КТГ плода - одновременная регистрация частоты сердечных тонов, его двигательной активности и тонуса матки. В тот же период развития пренатальной диагностики становится популярным медико-генетическое консультирование беременных с целью формирования групп повышенного генетического риска возникновения врожденных наследственных заболеваний плода. Генетика начинает активно искать подходы к получению информации о генетическом статусе плода. Эти подходы начинают реализовываться с появлением возможности производить инвазивные диагностические манипуляции.
Первая инвазивная манипуляция с целью получения плодного материала была произведена в 1956 г. в Великобритании. Для диагностики эритробластоза при резус-несовместимости матери и плода без визуального контроля осуществлен трансабдоминальный амниоцентез - пункция амниотической полости через переднюю брюшную стенку (ранее амниоцентез выполнялся трансвагинальным путем с целью прерывания беременности). С этого момента началась разработка методик культивирования клеток амниотической жидкости для последующего цитогенетического анализа.
В 1958 г. Donnald делает первое сообщение о применении в акушерстве ультразвукового сканирования. Принцип его основан на способности волны акустических колебаний ультразвукового диапазона отражаться от границы двух сред с различным акустическим сопротивлением.
В 1962 г. Sailing предложил новый метод визуального контроля состояния плода - амниоскопию, трансцервикальный осмотр нижнего полюса плодного пузыря.
В 1967 г. освоена методика культивирования клеток амниотической жидкости и произведен первый диагностический амниоцентез для пренатальной диагностики хромосомной патологии плода.
В начале 1970-х годов в США разработан и предложен к применению новый диагностический метод визуального контроля за плодом - фетоскопия, осмотр плода через оптическую систему специально приспособленного эндоскопа малого диаметра. А в Великобритании, Италии и Китае тогда же получила распространение новая инвазивная диагностическая процедура - биопсия хориона для пренатальной диагностики врожденных наследственных заболеваний.
С 1976 г. начинают проводиться биохимические исследования амниотической жидкости для определения зрелости легких плода и диагностики обменных заболеваний.
В 1977 г. Фиджеральд и Друмм сообщают о применении в акушерстве допплерометрии - исследования кровотока в артериях пуповины и аорте плода.
В начале 1980-х годов в США и Великобритании при выполнении фетоскопии получена кровь из пуповины плода с целью определения кариотипа плода. В 1983 г. Даффос произвел первый кордоцентез (пункцию вены пуповины) под визуальным контролем УЗИ. Этот метод широко использовался в странах Средиземноморья с целью пренатальной профилактики талассемии - генетически детерминированной гемоглобинопатии. В дальнейшем кордоцентез стал самой актуальной инвазивной диагностической процедурой; он применялся для получения наиболее информативной биологической ткани плода и последующей диагностики хромосомной патологии, некоторых биохимических заболеваний, инфицированности, а также для определения группы крови плода, переливания крови при гемолитической болезни плода.
В 1986 г. Мейлин и Куржак вводят в акушерскую практику новый метод двухмерной цветной допплеркардиографии.
В настоящее время к наиболее распространенным современным методам оценки состояния плода относятся следующие.
1. Ультразвуковое исследование с применением черно-белой и цветной допплерографии.
2. Кардиомониторное исследование сердечной деятельности плода с одновременной регистрацией его двигательной активности и тонуса матки.
3. Методы визуального контроля:
Амниоскопия;
Фетоскопия.
4. Инвазивные диагностические процедуры:
Амниоцентез;
Биопсия хориона;
Кордоцентез.
5. Определение концентрации основных гормонов беременности и факторов материнской сыворотки (эстрогены, ПЛ, ХГ, АФП и т.д.).
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ
В 1958 г. Доннальд делает первое сообщение о применении ультразвукового сканирования в акушерстве. Принцип основан на способности волны акустических колебаний ультразвукового диапазона отражаться от границы двух сред с различным акустическим сопротивлением. Все современные УЗ-приборы работают в режиме реального масштаба времени, т.е. непосредственного отображения информации, получаемой с УЗ-датчика, на экран дисплея. Картина, получаемая на экране дисплея, является масштабным изображением ультразвукового среза рассматриваемой зоны.
УЗИ в пренатальной диагностике занимает в настоящее время ведущее место, так как практически 70% основной информации о плоде можно получить с его помощью. Метод неинвазивен (т.е. неоперативный) и безопасен, о чем свидетельствует официальное сообщение Американского института ультразвука в медицине, сделанное в 1979 г. на основании анализа многочисленных проспективных исследований биологических эффектов ультразвука в медицине.
Проведение фето- и плацентометрии, определение количества околоплодных вод, а также оценка биофизической активности плода позволяют получить важную информацию как о состоянии плода, так и наличии ряда акушерских осложнений.
Таблица 10
УЗИ в I триместре
При проведении УЗИ в I триместре (табл. 10) необходимо уделять большое внимание анатомическому строению матки, состоянию придатков, развитию и динамическому изменению желточного мешка.
Аномалии развития матки и новообразования (чаще всего миомы) наиболее четко дифференцируются именно в I триместре, и их диагностика крайне важна для прогноза течения беременности и выбора оптимальной тактики ведения. Определение состояния шейки матки при исследовании в динамике позволяет вовремя диагностировать истмико-цервикальную недостаточность.
Объем информации, которую получают о плоде в ранние сроки беременности, довольно обширен: плодное яйцо в полости матки наблюдается с 2-3-й нед, визуализация тельца эмбриона и регистрация его сердцебиения возможна с 4-5-й нед, головка, как отдельное анатомическое образование, лоцируется с 8-й нед, после 12-й нед доступны для осмотра структуры головного мозга, позвоночник, лицо, грудная клетка, идентифицируются конечности, а в некоторых случаях _ кисти и стопы плода.
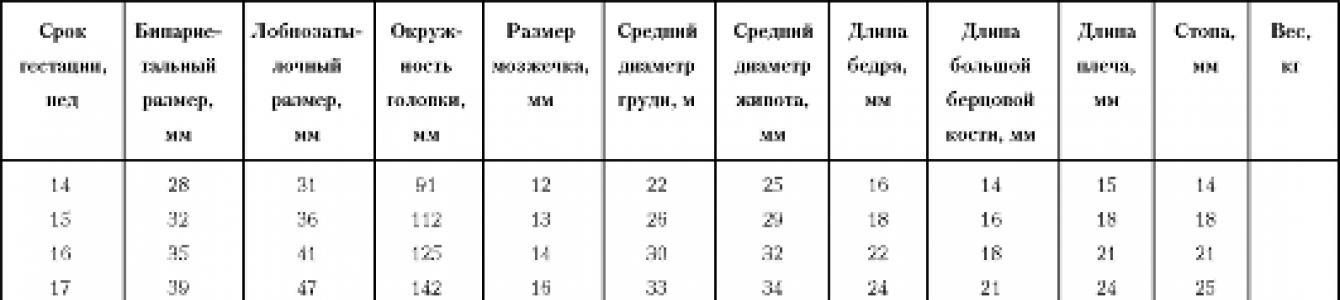
С увеличением срока беременности оценивают локализацию и структуру плаценты, количество и состав околоплодных вод, тонус миометрия. С начала II триместра беременности доступны измерению практически все фетометрические параметры (бипариетальный и лобно-затылочный размер головки, средний размер грудной клетки и живота, длина трубчатых костей и др.). Соответствие размеров плода сроку беременности проводится по фетометрическим таблицам, специфичным для конкретной популяции.
Размеры органов
Размеры сердца плода отражены в табл. 11, 12.
Таблица 11
Размеры сердца плода в разные сроки беременности
Примечание: *Измерение производят перпендикулярно межжелудочковой перегородке в конце диастолы в момент, предшествующий закрытию атриовентрикулярного клапана.
** Измеряется наибольший внутренний диаметр в конце систолы сразу после закрытия атриовентрикулярного клапана.
Таблица 12
Отношения размеров сердца во II и III триместрах
Размеры печени плода отражены в табл. 13
После 20 нед беременности измеряется так называемая «длинная ось» печени. Длинная ось определяется при продвижении УЗ-датчика параллельно брюшной аорте вправо до выведения максимального размера печени. Таким образом, длинная ось - это расстояние от правой половины диафрагмы до нижнего края печени.
Таблица 13
Размеры печени плода
Особого рассмотрения заслуживает пренатальная диагностика врожденных наследственных заболеваний (ВНЗ) и пороков развития плода (табл. 14, 15), которая возникла и успешно развивается на стыке двух дисциплин - генетики и ультразвуковой диагностики.
Таблица 14
Частота встречаемости врожденной и наследственной патологии
Таблица 15
Риск рождения новорожденного с синдромом Дауна
Возраст матери Дауна, % | Риск синдрома аберраций, % | Риск хромосомных болезней |
Основную информацию по выявлению ВНЗ плода дает УЗИ во II триместре беременности в сроки от 16 до 28 нед, когда сформированы и доступны подробному исследованию практически все органы и системы плода и «включаются» синдромологические особенности врожденного или наследственного заболевания, именуемые термином «стигмы дизэмбриогенеза». К стигмам (или, как их еще называют, «маркерам» ВНЗ) относятся, например, шейная складка, низкое расположение ушных раковин, уплощенный профиль лица, гипер- и гипотелоризм и т.д.
Антенатальные проявления ВНЗ плода на первый взгляд могут быть незначительными, например в виде многоводия или асимметрии развития плода, и задача специалиста УЗ-диагностики состоит в умении распознавания дополнительных фенотипических особенностях плода как маркеров ВНЗ. Выявление комплекса специфических маркеров ВНЗ - показание для дополнительного исследования плода с целью диагностики некурабельной патологии.
Фетометрическая таблица

 УЗИ-критерии трисомии 21 (синдром Дауна).
УЗИ-критерии трисомии 21 (синдром Дауна).
Утолщение шейной складки.
Укорочение бедренной кости.
Порок сердца.
Гипертелоризм.
УЗИ-критерии трисомии 18 (синдром Эдвардса).
Многоводие.
Микрогнатия.
Деформация пальцев рук.
Деформация стоп.
Укорочение I пальца стопы.
Единственная артерия пуповины.
Омфалоцеле.
Важным моментом комплексного синдромологического исследования плода является умение проводить дифференциальную диагностику между маркерами ВНЗ и конституциональными наследственно обусловленными особенностями развития. Фенотипические особенности развития плода, сходные с фенотипическими особенностями родителей, как правило, не выражены в сроки до 28 нед и наиболее сильно проявляются после 32 нед. Точность диагностики так называемых ультразвуковых стигм, или маркеров ВНЗ, при соответствующей квалификации специалиста достигает 70-80%. До 27 нед возможно диагностировать до 95% всех видов пороков развития плода и даже такую патологию, как отслойка сетчатки глаза.
Один из важных вопросов пренатальной диагностики - определение состояния плода при доношенной беременности перед родами. Поэтому большое внимание при УЗИ необходимо уделять поведенческим реакциям плода (в том числе общей двигательной активности, мышечному тонусу, дыхательным движениям, моторике желудочно-кишечного тракта и т.д.) как диагностическим критериям гипоксического состояния. Особого внимания требует объем околоплодных вод (рис. 44, 45).
 Рис. 44.
Физиология обмена околоплодных вод (при доношенной беременности)
Рис. 44.
Физиология обмена околоплодных вод (при доношенной беременности)
 Рис. 45.
Динамика увеличения объема околоплодных вод
Рис. 45.
Динамика увеличения объема околоплодных вод
Основные причины многоводия
Инфицирование.
Трансфузионный синдром (плод-реципиент).
Порок развития плода.
Сахарный диабет.
Изосерологическая несовместимость. Основные причины маловодия
Хроническая гипоксия плода.
Амнионит.
Пороки развития плода.
Разрыв плодных оболочек.
Говоря об оценке поведенческих реакций плода, необходимо отметить, что новорожденный в нормальном физиологическом состоянии спит около 90% времени. Описаны две стадии сна у новорожденных: тихий сон и REM («rapid eye movements») сон. Тихий сон характеризуется тонической активностью мускулатуры, отсутствием двигательной активности, типичными ЭЭГ, сердечным ритмом и типом дыхания. REM-сон (стадия II) характеризуется движениями конечностей или генерализованными потягивающимися движениями, типичными ЭЭГ, ЧСС и дыхательными движениями.
Допплерометрия
В 1977 г. Фиджеральд и Друмм сообщают о применении в акушерстве допплерометрии (рис. 46, см. вклейку) - исследования кровотока в артериях пуповины и аорте плода. Регистрация кривых скоростей кровотока плода основана на эффекте Допплера, открытом в 1842 г. (разница частот акустических волн ультразвукового диапазона, излучаемых пьезоэлектрическим датчиком и отраженных от движущихся частиц). Простота применения и неинвазивность метода, возможность длительного применения как во время беременности, так и в родах быстро завоевывают симпатии практических акушеров.
По степени изменения параметров кровотока, измеряемых при помощи данного метода, можно на ранних стадиях предположить различные нарушения роста и развития плода. Для оценки кривых скоростей кровотока наиболее часто используются параметры, значения которых не зависят от угла наклона ультразвукового луча к исследуемому сосуду: индекс резистентности (ИР), пульсационный индекс (ПИ) и систолодиастолическое отношение (СДО).
В 1986 г. Мейлин и Куржак применяют в акушерской практике новый метод двухмерной цветной допплеркардиографии. Цветное допплеровское картирование позволяет быстро и точно осуществлять поиск даже самых мелких сосудов плода и производить качественную регистрацию кривых скоростей кровотока.
Кардиотокография
Это одновременная регистрация ЧСС, двигательной активности плода и тонуса матки. Кардиотокограф автоматически расчитывает ЧСС в 1 мин и регистрирует на графике в виде кривой.
Сердечный ритм может быть условно подразделен на три основных параметра: базальный ритм (БР), вариабельность сердечного ритма и периодические изменения.
БР - это средняя величина между мгновенными значениями ЧСС за 10 мин при отсутствии стрессорного воздействия на плод. Частота БР - результат параллельного воздействия на собственный автономный сердечный ритм симпатической и парасимпатической нервных систем.
Нормальный БР составляет 120-160 уд/мин. при головном предлежании плода и 110-180 - при тазовом. Патологический вариант БР - синусоидальный ритм (рис. 47), который наблюдается как антенатально, так и в родах, и обычно связан с тяжелой степенью анемии или гипоксии плода.
Тахикардия - определяется ЧСС более 160 (180) уд/мин. Причины возникновения тахикардии.
1. Легкая степень гипоксии плода.
2. Лихорадка матери.
3. Амнионит.
4. Гипертиреоидизм матери.
5. Анемия плода.
6. Лекарственные препараты (β -симпатомиметики, парасимпатолитики (атропин).
Брадикардия - определяется ЧСС менее 120 (110) уд/мин. Причины возникновения брадикардии.
1. Средняя и тяжелая степени гипоксии плода.
2. Блокада проводящей системы сердца при: а) врожденных пороках сердца; б) коллагенозах.
3. Лекарственные препараты (β -блокаторы).

Рис. 47. Синусоидальный базальный ритм
Вариабельность сердечного ритма. Интервалы между двумя последующими сердечными сокращениями хорошо оксигенированного плода не бывает одинаковыми. Таким образом, при графической регистрации мгновенной ЧСС БР представляется нерегулярным (извилистая кривая). Эта нерегулярность сердечного ритма определяется термином «вариабельность».
Вариабельность сердечного ритма характеризуется амплитудой и частотой.
Амплитуда - величина отклонений от БР. Нормальная амплитуда составляет 6-25 уд/мин. За отсутствие вариабельности ритма принимается амплитуда менее 5 уд/мин («монотонный» ритм, рис. 48) и менее 2 уд/мин («немой» ритм).
 Рис. 48.
Монотонный сердечный ритм
Рис. 48.
Монотонный сердечный ритм
БР с амплитудой более 25 уд/мин называется «сальтаторным» и свидетельствует о сдавлении пуповины плодом или обвитии вокруг шеи и/или туловища.
Частота - это количество осцилляции в 1 мин. Норма = 7-12.
Вариабельность ритма обусловлена взаимодействием ЦНС, симпатической и парасимпатической нервных систем и собственной иннервации сердца. Изменение вариабельности может быть вызвано нарушением в одной или нескольких системах.
Причины снижения вариабельности БР.
1. Гипоксия - ацидоз.
2. Врожденные аномалии сердечно-сосудистой системы.
3. Недоношенность.
4. Тахикардия.
5. Цикл сна плода.
6. Действие медикаментов (депрессанты, наркотические анальгетики, барбитураты, транквилизаторы, седативные и антигистаминные препараты, парасимпатолитики, общие анестетики).
Периодические изменения ритма сердца обычно связаны с сокращениями матки и движением плода и включают децелерации разных типов (урежение ритма) и акцелерации (учащение ритма).
Акцелерации - это медленные ускорения сердечного ритма. В норме за 30 мин исследования должно быть не менее двух акцелераций амплитудой не менее 15 уд/мин и продолжительностью не менее 15 с.
Децелерации - это медленные замедления ритма. По степени тяжести различают: легкие - до 15 уд/мин; средней тяжести - 16-45 уд/мин; тяжелые децелерации - более 45 уд/мин. При развитии регулярной родовой деятельности возможно возникновение ранних (dip I), поздних (dip II) и вариабельных (dip III) децелераций.
Термин «децелерации» был введен Hon, а термин dips - CaldeyroBarcia.
Ранние децелерации (рис. 49.) - рефлекторная реакция ЧСС плода на сдавление головки во время схватки, обусловленная центральной ваготонией при повышении внутричерепного давления. По форме отражают кривую сокращения матки с той же длительностью и амплитудой. В норме могут возникать при открытии акушерского зева на 4-7 см.
 Рис. 49.
Ранние децелерации
Рис. 49.
Ранние децелерации
Поздние децелерации (рис 50) отражают нарушение кровообращения в межворсинчатом пространстве при сокращении матки. Урежение ритма начинается через 30-60 с после начала схватки и продолжается обычно более 30 с. Максимальный пик урежения ритма (перигей) - через 30-60 с после пика схватки или после ее окончания.
 Рис. 50.
Поздние децелерации
Рис. 50.
Поздние децелерации
Причины возникновения поздних децелерации, вероятно, заключаются в следующем. Известно, что фетоплацентарная недостаточность (ФПН) характеризуется постепенным уменьшением передачи кислорода и питательных веществ к плоду. Было предположено, что пассаж питательных веществ является первой функцией, которая нарушается при ФПН (развитие ЗВУР), за чем следует снижение респираторной функции плаценты (развитие гипоксии плода). Персистирующая гипоксия ведет к развитию анаэробного метаболизма и ацидоза плода. В тех случаях, когда сокращения матки вызывают повышение внутриматочного давления более чем на 30 мм рт.ст., оксигенированная кровь прекращает поступать из открытых межворсинчатых пространств. В связи с этим РО 2 в крови плода падает, но при наличии у него нормального кислородного запаса - не ниже критического уровня 17-18 мм рт.ст. Следовательно, у таких плодов не будут возникать периодические поздние децелерации. Если же у плода сниженный кислородный резерв, то сокращения вызывают падение РО 2 и поздние децелерации. Поздние децелерации могут обусловливаться двумя механизмами. Автономный рефлекторный механизм наблюдается у плодов с ранней гипоксией. Второй механизм включает прямую миокардиальную депрессию, обычно следующую за первым механизмом, когда гипоксия плода достаточно выражена и становится причиной метаболического ацидоза.
Вариабельные децелерации (рис. 51) возникают вне зависимости от сокращений миометрия и связаны с патологией пуповины (в 50% - с обвитием пуповины вокруг шеи и/или туловища). При отсутствии других нарушений ритма вариабельные децелерации не свидетельствуют о страдании плода.
 Рис. 51.
Вариабельные децелерации
Рис. 51.
Вариабельные децелерации
В настоящее время в антенатальной диагностике с использованием метода КТГ применяются следующие тесты.
1. Нестрессовый тест (НСТ).
2. Контрактильный тест:
а) окситоциновый тест (ОТ);
б) маммарный тест (МТ).
Когда появился метод КТГ, было отмечено: появление глубоких децелераций до развития родовой деятельности или в I периоде родов грозит неблагоприятным исходом для плода. В связи с этим возникло желание путем индуцирования тонуса матки (на 30 мм рт.ст.) в антенатальном периоде исследовать состояние маточно-плацентарного кровотока и резервные возможности плода в отношении кислородного голодания. Использовали ОТ: внутривенно капельно вводили окситоцин в дозе 0,5 мЕД/мин с удвоением скорости введения через 15-20 мин до появления схваток продолжительностью 40-50 с через 5-6 мин. Другой
способ индукции сокращений - МТ, механическое давление сосков беременной в течение 10 мин до появления тонуса миометрия.
Положительный ОТ означает появление «персистирующих поздних децелераций» и до настоящего времени считается достоверным тестом для определения ФПН - состояния, сопровождающего 2 / 3 случаев перинатальной смертности.
В большинстве случаев беременностей высокого риска возможно применение ОТ с 32-й нед гестации. При тяжелом СЗРП, прогрессирующей гипертензии и при маловодии требуется более раннее начало тестирования. Однако контрактильный тест в ряде случаев небезопасен и противопоказан беременным с данными о перенесенном кесареве сечении в анамнезе, признаками угрожающих преждевременных родов, при предлежании и отслойке плаценты, многоводии.
 Рис. 52.
Реактивный НСТ
Рис. 52.
Реактивный НСТ
Нестрессовый тест
В конце 1960-х годов была установлена взаимосвязь между наличием акцелераций сердечного ритма в антенатальном периоде и благоприятным перинатальным исходом при применении длительного кардиомониторинга - НСТ. При наличии акцелераций НСТ считается реактивным и указывает на удовлетворительное состояние плода (рис. 52). Отсутствие акцелераций (нереактивный НСТ) указывает на страдание плода, если только плод не находится в состоянии сна или под действием медикаментов. В настоящее время НСТ используется в качестве рутинного пренатального скрининга беременных высокого риска, а также как важный компонент биофизического профиля плода.
БИОФИЗИЧЕСКИЙ ПРОФИЛЬ ПЛОДА
Manning и соавт. (1980) объединили данные, полученные при проведении УЗИ и НСТ, и создали так называемую балльную систему биофизического профиля (БФП) плода. Manning оценивает нормальные параметры БФП в 2 балла, а патологические - в 0 баллов. Некоторые исследователи дополнили понятие БФП и предложили несколько модификаций системы его оценки. Так, у Vintzileos (1985) система 3-бал- льная, 1 балл означает пограничное состояние; автор ввел в БФП шестой компонент - степень зрелости плаценты: 2 балла соответствуют 0, I, II степени зрелости, 1 балл - неясной степени зрелости при расположении плаценты на задней стенке; 0 баллов - III степени зрелости, связанной с более высокой частотой патологического сердечного ритма и отслойки плаценты в родах. По данным ряда авторов, при изъятии НСТ из схемы определения БФП прогностическая ценность 8-балльной шкалы соответствует таковой 10-балльной шкалы.
БФП - отражает степень риска для плода, выявляемую на основе комплексной оценки маркеров как острого, так и длительно текущего страдания плода. Гипоксемическая стимуляция рецепторов дуги аорты вызывает глубокое перераспределение сердечного выброса. Кровоток к мозгу, сердцу, надпочечникам и плаценте увеличивается, а к другим органам - уменьшается. Во второй половине беременности почки и легкие плода становятся основным источником продукции околоплодных вод, и снижение кровотока в этих органах неминуемо приводит к уменьшению такой продукции и развитию маловодия.
ИНВАЗИВНЫЕ ДИАГНОСТИЧЕСКИЕ ПРОЦЕДУРЫ
Амниоцентез - пункция амниотической полости для аспирации амниотической жидкости.
Первая инвазивная манипуляция с целью получения плодного материала произведена в 1956 г. в Великобритании - трансабдоминальный амниоцентез, т.е. пункция амниотической полости через переднюю брюшную стенку (ранее амниоцентез выполнялся трансвагинальным путем для прерывания беременности). Процедура производится трансабдоминальным или трансвагинальным способом (пункция переднего свода влагалища). Применяется с 11-12 нед беременности и вплоть до родов с целью цитогенетической диагностики хромосомной патологии плода; диагностики эритробластоза, наследственных заболеваний обмена; при необходимости проведения иммуноферментного анализа амниотической жидкости на АФП при подозрении на наличие свищевых дефектов нервной трубки; с целью оценки зрелости легочной ткани на основании анализа соотношения лецитин - сфингомиелин, определения уровня фосфатидилглицерола и других биохимических компонентов околоплодных вод, а также для диагностики степени выраженности гипоксии плода на основании уровня кислотности.
Биопсия хориона проводится в I триместре беременности. Существуют две методики проведения биопсии: трансабдоминальная и трансцервикальная.
Кордоцентез
В 1983 г. Даффос производит первый кордоцентез (пункцию вены пуповины) под визуальным контролем УЗИ. Наиболее часто кордоцентез применяется с 18-й нед беременности, однако при наличии УЗ-сканеров с высокой разрешающей способностью кордоцентез можно выполнять с 12-й нед беременности.
Риск осложнений (прерывание беременности, инфицирование, кровотечение и смерть плода) при проведении инвазивных процедур составляет 0,5-2,5%.
методы визуального контроля
Амниоскопия - трансцервикальный осмотр плодного пузыря, применяется для визуальной качественной оценки околоплодных вод при доношенной беременности и (при необходимости) в более ранние сроки.
В цервикальный канал вводится амниоскоп с мандреном, мандрен удаляется, после чего подключается осветительная система и подводится оптический окуляр. При неосложненном течении беременности в предлежащей части плодного пузыря определяется достаточное количество светлых прозрачных опалесцирующих околоплодных вод с наличием белой сыровидной смазки.
Обнаружение хлопьев мекония, зеленоватая окраска вод и оболочек могут указывать на гипоксическое состояние плода; примесь коричневого мекония - на наличие резус-конфликтной беременности, гемолитической болезни плода, а также на открытые дефекты желудочно-кишечного тракта.
Основным осложнением амниоскопии является разрыв плодного пузыря, излитие околоплодных вод. В настоящее время амниоскопия применяется как вспомогательный метод для уточнения диагноза.
Фетоскопия - метод, позволяющий осуществить непосредственный визуальный осмотр плода. Фетоскопию производят специальным эндоскопическим прибором в сроки от 16 до 22 нед беременности. По сущности технического выполнения исследования фетоскопия идентична лапароскопии и гистероскопии.
Есть два способа введения фетоскопа - трансабдоминальный и трансвагинальный. Перед фетоскопией обязательно с помощью прицельного УЗИ определяют положение плода в матке, расположение и состояние плаценты и состояние миометрия. Фетоскопия противопоказана при: расположении плаценты по передней стенке матки, предлежании плаценты, наличии множественной миомы матки с преимущественным расположением миоматозных узлов по передней стенке, выраженном варикозе миометрия передней стенки матки.
Риск прерывания беременности при проведении фетоскопии составляет 3-8%. Существенный недостаток метода - опасность развития у женщины осложнения в виде внутрибрюшного кровотечения и эмболии околоплодными водами. В связи с этим фетоскопия применяется в настоящее время в редких случаях, в основном для диагностики кож-
ных заболеваний плода, при отсутствии лабораторных методов диагностики, а также при узкоспецифических наследственных заболеваниях, требующих визуальной диагностики.
Оценка концентрации плацентарных гормонов и факторов материнской сыворотки крови
В течение десятилетий врачи пытались определить состояние плода посредством мониторинга уровней содержания различных гормонов плаценты или фетоплацентарного комплекса.
Хорионический гонадотропин человека
Предполагается, что ХГ человека секретируется синцитиотрофобластом. Скорость секреции ХГ быстро увеличивается в первые несколько недель беременности, при этом максимальные его уровни (около 100 ЕД/мл) в крови и моче матери достигаются к 10-й неделе гестации. После чего содержание ХГ как в плазме, так и в моче матери постепенно уменьшается, достигая минимума приблизительно к 120-му дню гестации. Затем концентрация ХГ в плазме сохраняется на уровне около 20 ЕД/мл.
Подъемы уровня ХГ обнаруживаются у женщин с многоплодной беременностью и пузырным заносом или хориокарциномой. Позднее в течение беременности увеличение количества ХГ также может наблюдаться у женщин с Rh-изоиммунизацией, при пороках развития плода и сахарном диабете. В последних двух случаях отмечается повторное появление цитотрофобласта в плаценте на более поздних сроках беременности.
Физиологическая роль ХГ при беременности не определена полностью. Вероятно, ХГ дает лютеотропный эффект, т.е. поддерживает функцию желтого тела. Возможно также, что ХГ индуцирует секрецию тестостерона яичками плода до начала секреции ЛГ гипофизом плода. Некоторые исследователи отметили роль ХГ в иммунологической защите трофобласта.
Плацентарный лактоген
ПЛ также секретируется синцитиотрофобластом; секреция ПЛ может начаться в день или за день до нидации. Однако динамика секреции ПЛ отличается от таковой ХГ. Концентрация в материнской крови нарастает медленно и, по-видимому, параллельно плацентарной массе.
Максимальные уровни достигаются после 32 нед гестации и затем остаются относительно постоянными. Скорость секреции ПЛ у беременных превышает таковую всех других белковых гормонов у женщин и у мужчин и составляет 1 г и более в поздние сроки нормально протекающей беременности. Гормон имеет как лактогенные, так и соматотропные свойства. Однако его потенциальная способность содействовать росту составляет около 1/100 способности гипофизарного гормона роста.
Небольшое количество ПЛ попадает в циркуляцию крови плода. ПЛ является антагонистом инсулина и может быть отчасти ответственным за развитие сахарного диабета у беременных, которые не знали о наличии этого заболевания до беременности или которым не требовалась инсулинотерапия после того, как беременность была прервана (гестационный диабет). Однако прямого доказательства такому предположению не найдено. Были описаны явно нормально протекающие беременности, при которых не обнаруживался ПЛ ни в материнской крови, ни в плаценте.
Поскольку ПЛ секретируется трофобластом и поскольку скорость секреции ПЛ в основном пропорциональна увеличению массы плаценты, измерение уровней ПЛ проводилось с целью определения функции плаценты и (косвенно) состояния плода.
При беременностях высокого риска, особенно осложненных гипертензией, имеется значительная корреляция между уровнями ПЛ и исходом для новорожденного. Эта корреляция не выше, чем между исходом и уровнями эстриола (Е 3).
Эстриол
Определение эстриола в плазме и моче матери использовалось и до сих пор используется в некоторых институтах в качестве мониторинга состояния плода, поскольку Е 3 формируется в плаценте первично из С19-стероидов. При гипоксии у плода, по-видимому, происходит снижение секреции гипофизарного АКТГ, скорости секреции дигидроэпиандростерона сульфата (ДГЭА-С) надпочечниками и, как следствие, скорости секреции Е 3 . Если имеет место беременность высокого риска, то при уменьшении содержания Е 3 или при небольшом его количестве прогнозируют ожидаемое поражение плода. После смерти плода отмечается значительное падение уровней Е 3 в плазме и моче матери. Однако при некоторых беременностях с несомненным риском для плода содержание эстрадиола может не снижаться (например: беременности с
поражением плода при резус-иммунизации; беременности, осложненные сахарным диабетом). В подобных случаях количество Е 3 в плазме и моче матери порой бывает выше, чем при нормальной беременности в те же сроки.
Вернемся к основному вопросу: является ли измерение уровня Е 3 в плазме и моче матери показателем состояния плода, способным повлиять на выбор идеального времени родоразрешения? Обычно выбирать приходится между недоношенностью и ухудшением состояния плода. К сожалению, рядом авторов отмечено: измерение содержания Е 3 в плазме и моче матери не дает значимой информации сверх получаемой при клиническом обследовании беременной. Клиническая оценка осуществляется путем определения скорости роста плода по клиническим и сонографическим критериям, путем систематического измерения артериального давления и оценки функции почек у беременной. Плод подвергается риску при прогрессировании гипертензии, у беременных с диабетом, у которых не контролируется метаболизм карбогидратов, а также в случае отсутствия соответствующего увеличения бипариетального размера головки. У одной и той же пациентки и у разных беременных уровни содержания Е 3 широко варьируют, поэтому выбор срока родов на основании их определения без учета других факторов может принести больше вреда, чем пользы. Многие исследователи не разделяют такую точку зрения. Их возражения сводятся к тому, что определение уровней Е 3 может иметь ценность, если рассматривать их в контексте полной информации, имеющейся в распоряжении врача о беременности, при которой существует риск для плода. Однако в одном проспективном контролируемом исследовании данные о Е 3 не сыграли роли в снижении перинатальной смертности и заболеваемости.
Альфа-фетопротеин - специфичный для плода гликопротеид, размерами 70 000 дальтон, продуцируется в ранние сроки гестации. Функциональная роль неизвестна. Синтезируется в желточном мешке, желудочно-кишечном тракте и печени плода. Максимальная концентрация наблюдается как в плазме плода, так и в амниотической жидкости в 12-14 нед гестации. Соотношение концентрации АФП в сыворотке крови плода и в амниотической жидкости составляет 150/1-200/1.
Исследование уровня АФП в сыворотке матери первоначально использовалось для определения дефектов невральной трубки. В настоящее время скрининг АФП успешно применяется в диагностике другой разнообразной генетической патологии и акушерских осложнений. Так,
взаимосвязь между хромосомными патологиями плода и низким уровнем АФП установлена окончательно. Последний изменяется также при угрозе преждевременных родов и прогнозирует СДР плода.
Эмбриология и эпидемиология дефектов невральной трубки
Невральная трубка, являющаяся предшественником ЦНС, закрывается между 22-м и 28-м днем после зачатия. Недостаточное закрытие цефалической порции трубки часто ведет к анэнцефалии - врожденному отсутствию свода черепа и передней части черепной коробки. Эта аномалия неизбежно приводит к смерти живорожденных анэнцефалов в течение 1-2 дней. Недостаточное закрытие каудальной части невральной трубки вызывает SPINAE BIFIDA; уровень дефекта определяется стадией развития плода, на которой произошло недостаточное закрытие каудального конца невральной трубки. Дети со SPINAE BIFIDA имеют обычно моторный паралич и недостаточную чувствительность ниже уровня дефекта, дисфункцию мочевого пузыря и хронические заболевания почек, а 75% таких детей - гидроцефалию. Частота встречаемости дефекта составляет 1-2 на 1 тыс. живорожденных. Каждый год рождаются примерно 6 тыс. детей с дефектами невральной трубки. Последние чаще всего наблюдаются у детей-первенцев, чаще у девочек, чем у мальчиков. Половая пропорция для анэнцефалов - 0,45, а для новорожденных со SPINAE BIFIDA - 0,67.
Частота дефектов невральной трубки наиболее высока у кавказских народов. 90-95% детей с такими дефектами рождаются от родителей, не имеющих потомства с данным пороком или какого-либо фактора риска. В подобных семьях риск рождения второго пораженного ребенка - 1,5-3%. Значительное количество дефектов невральной трубки сочетается с хромосомной патологией, поражением одного гена и синдромом амниотических перетяжек. Некоторые факторы окружающей среды могут увеличивать риск развития дефектов невральной трубки. При инсулинзависимом диабете имеет место 2% риск развития дефектов невральной трубки и анэнцефалии; назначение противосудорожных препаратов сочетается с 1-2% частотой дефектов невральной трубки. Дефицит фолиевой кислоты, возможно, также способствует формированию дефекта. Однако вероятно, что особо важную роль в его развитии играют генетическая предрасположенность и дефицит витаминов.
АФП проникает в амниотические воды с мочой плода и секретом желудочно-кишечного тракта, а также путем транссудации из плодовых
сосудов в плацентарные. Как АФП попадает в материнскую сыворотку, точно не известно, но вполне возможно - посредством диффузии из плодовых сосудов в плаценту и затем в материнскую циркуляцию.
Комплексная оценка основных гормонов и факторов материнской сыворотки позволяет предположить с высокой степенью достоверности некоторые пороки развития плода.
В течение десятилетий врачи пытались определить состояние плода посредством мониторинга уровней различных гормонов фетоплацентарного комплекса. Однако теперь показано: по абсолютным концентрациям гормонов часто нельзя судить об истинном состоянии плода; для точной диагностики и прогноза необходимы серийные исследования. Некоторыми авторами отмечено: измерения содержания гормонов матери не дают более значимой информации, чем получаемая при клиническом обследовании беременной. Поэтому в настоящее время методики определения количества основных гормонов беременности вытесняются более дешевыми и высокопрогностичными неинвазивными диагностическими методами.
интранатальная оценка состояния плода
Основными методами интранатальной диагностики являются КТГс интерпретацией децелераций и характера БР, а также оценка кислотнощелочного состояния крови плода. Комплексная оценка состояния плода в родах во многом определяет время и метод родоразрешения.
Тактика ведения родов при ацидозе
 В
заключение следует сказать, что пренатальная диагностика имеет большой
арсенал методов, позволяющих с высокой точностью оценить состояние
плода, исключить большинство наследственных заболеваний и прогнозировать
постнатальный исход. На современном этапе развития акушерства
использование инструментальных методов оценки состояния плода,
применяемых в большинстве клиник рутинно, является неотъемлемой частью
повседневной практической работы акушера-гинеколога.
В
заключение следует сказать, что пренатальная диагностика имеет большой
арсенал методов, позволяющих с высокой точностью оценить состояние
плода, исключить большинство наследственных заболеваний и прогнозировать
постнатальный исход. На современном этапе развития акушерства
использование инструментальных методов оценки состояния плода,
применяемых в большинстве клиник рутинно, является неотъемлемой частью
повседневной практической работы акушера-гинеколога.
Методы пренатальной диагностики наследственных болезней
Разработка методов пренатальной диагностики наследственных болезней оказалось крупнейшим достижением медицинской генетики и столь существенно изменила отношение семей к риску рождения больного ребенка, что этот раздел стал составной и часто очень важной частью медико-генетического консультирования.
Методы пренатальной диагностики подразделены на 2 группы:
Неинвазивные методы.
Инвазивные методы.
Неинвазивные методы:
Ультразвуковое исследование. Метод основан на способности высокочастотных колебаний распространятся в средах организма с разной частотой и глубиной проникновения. Во время беременности проводится:
при массовом скрининге в сроке 15-16 и 23-24 недели
при патологическом течении беременности УЗИ в 1 триместре проводят для определения срока, многоплодия, пузырного заноса, локализации плаценты. Во 2 и 3 триместрах беременности при помощи УЗИ можно диагностировать следующие патологические состояния плода:
16 недель беременности- анэнцефалия, гидроцефалия, микроцефалия, спинномозговая грыжа;
20 недель беременности - пороки развития желудочно-кишечного тракта, пороки развития почек;
26-27 недель беременности - пороки сердца.
Метод УЗИ позволяет выявить многоводие, которое часто является следствием внутриутробного инфецирования, а также маловодие, характерное для аутосомных трисомий.
Определение альфа-фетопротеина в сыворотке беременной женщины.
Альфа-фетопротеин (АФП) - специфический белок, продуцируемый клетками желточного мешка, а на последующих этапах внутриутробного развития клетками печени плода. АФП проходит через плаценту и определяется в крови матери. У взрослых АФП не синтезируется. Для каждой недели беременности характерен свой уровень АФП. Максимальная концентрация АФП определяется на 16-18 неделях беременности. Именно в этот срок исследуется сыворотка беременных. Нормальные значения АФП для этого срока беременности = 0,5-2,5 мом .
Уровень АФП повышен при следующих заболеваниях:
дефекты нервной трубки (анэнцефалия, гидроцефалия, спинномозговая грыжа, черепно-мозговая грыжа)
спонтанная внутриутробная гибель плода;
омфалоцеле;
синдром Шерешевского - Тернера;
врожденный нефротический синдром;
кресцово - копчиковая тератома;
экстрофия мочевого пузыря;
фокальная гипоплазия дермы;
синдром Меккеля;
Уровень АФП снижен при аномалиях аутосом (болезнь Дауна, синдром Патау, Эдвардса др.).
При изменении уровня АФП в сыворотке беременной решается вопрос о применении инвазивных методов пренатальной диагностики.
Инвазивные методы пренатальной диагностики
Трансабдоминальный амниоцентез. Срок проведения 16-17 неделя беременности. После проведения УЗИ, при котором определяют локализацию плаценты, срок беременности, под местной анестезией проводят прямую пункцию матки и извлекают 10-12 мл околоплодных вод. Полученный материал используют следующим образом:
а) прямое исследование полученных клеток: для определения пола плода (Х и У хроматин); выявление морфологических изменений клеток.
б) прямое исследование околоплодных вод: для определения уровня альфа-фетопротеина, биохимических маркеров моногенных заболеваний, биохимических показателей, характеризующих состояние плода (уровень сурфактанта, билирубина и др.).
в) культивирование полученных клеток плода в течение 2-3 недель. В последующем к культуре клеток исследуют кариотип плода, уровень метаболизма клеток для диагностики многих болезней обмена, при наличии молекулярно-генетических методов -генные дефекты.
Наследственные заболевания, диагностируемые на основании прямого исследования ферментов в клетках амниотической жидкости: адреногенитальный синдром, цистиноз, болезнь Фабри, галактоземия, недостаточность глюкозо - 6-фосфатдегидрогеназы, гемофилия А и В, мукополисахаридозы, болезнь Тея-Сакса.
Моногенные заболевания, которые можно диагностировать с помощью молекулярно генетических методов: и -таласемия, фенилкетонурия, синдром Леш-Наяйяна, адреногенитальный синдром, гемофилия А и В, муковисцидоз, миопатия Дюшена, хорея Гентингтона, поликистоз почек, миотония Дюшена, болезнь Реклингаузена, пигментный ретинит, эктодермальная дисплазия, недостаточность антитрипсина, порфирия.
Осложнения амниоцентеза составляют 1% от всех операций и заключаются в травматизации плода и плаценты, повреждении магистральных сосудов, инфецировании, кровотечении, прерывании беременности.
Недостаток амниоцентеза - поздний (на 19-20 неделе беременности) срок получения результатов исследования.
Хориоцентез. Этот метод заключается в получении клеток хориона путем биопсии. Хорион закладывается из клеток зиготы и имеет тот же хромосомный состав, что и плод. Биопсию проводят путем трансцервикальной аспирации клеток, либо трансабдоминальным центезом.
Срок проведения: 7-9 неделя беременности.
Кордоцентез. Метод включает получение крови плода из сосудов пуповины. Материал, полученный при кордоцентезе является самым достоверным и информативным для проведения цитогенетической и биохимической диагностики. Недостатком метода является техническая сложность выполнения.
Биопсия кожи плода.
Фетоскопия.
Показания к применению инвазивных методов пренатальной диагностики:
Возраст матери: абсолютное показание - более 40 лет, относительное - более 35 лет;
Наличие в семье больных с хромосомной патологией;
Носительство сбалансированной хромосомной транслокации у родителей;
Определение пола плода при Х - сцепленных моногенных заболеваниях;
При риске моногенных заболеваний, если пренатально можно определить биохимические или молекулярно-генетические маркеры данного заболевания;
Если установлен повышенный или пониженный уровень альфа-фетопротеина в сыворотке беременной женщины.
|
НЕИНВАЗИВНЫЕ МЕТОДЫ ПРЕНАТАЛЬНОЙ ДИАГНОСТИКИ |
|||||||
|
Название метода |
Сроки беременности |
Показания к проведению |
Объект исследования |
Методика проведения |
Возможности метода |
Достоинства метода |
|
|
Скрининг материнских сывороточных факторов |
Промежуток между 15 и 20 неделями беременности. В ряде случаев возможно более ранее проведение анализа, но после 20 недели диагностическая ценность метода невысока. |
Венозная кровь беременной. |
Сыворотка крови исследуется на содержание трех веществ: альфа-фетопротеина(АФП) ; хорионического гонадотропина (ХГ) ; неконъюгированного эстриола (НЭ) . Иногда «тройной тест» дополняют исследованием уровня нейтрофильной щелочной фосфатазы(НЩФ) . |
Диагностика 2 : синдрома Дауна; некоторых уродств головного или спинного мозга (анэнцефалия, черепно-мозговые или спинномозговые грыжи) и ряда других тяжелых пороков развития у плода. |
Достаточно большая эффективность: 70% всех случаев синдрома Дауна и дефектов закрытия нервной трубки можно выявить на сроках 15-22 недели беременности. При дополнительном исследованииНЩФ выявление плодов с синдромом Дауна достигает 80%. Это дает возможность при принятии семьей соответствующего решения прервать беременность без особых осложнений для организма женщины. Риск осложнений для плода пренебрежимо мал. |
На результаты анализов оказывают влияние различные факторы - многоплодная беременность, особенности женского организма, акушерские проблемы и пр. Следствием этого нередко могут быть ложноотрицательные либо ложноположительные результаты исследования. Во всех подозрительных случаях назначается уточняющее обследование УЗ-сканирование, амниоцентез, плацентоцентез или кордоцентез. |
|
|
Ультразвуковой (УЗ) скрининг плода, оболочек и плаценты |
Стандартный акушерский УЗ-скрининг пороков развития у плода проводят в два этапа: на сроках 11-13 недель беременности и 22-25 недель беременности. |
Показан всем беременным женщинам. |
Плод и плацента |
1 способ. На поверхность живота женщины устанавливается датчик (трансдюсер), испускающий звуковые волны высокой частоты. Отражаясь от тканей плода, эти волны снова улавливаются датчиком. Компьютерная обработка волн формирует сонограмму - изображение на экране монитора, которое и оценивается специалистом. 2 способ (чаще используется на ранних сроках). Трансдюсер особой конструкции, защищенный латексным презервативом, вводится во влагалище женщины. |
Диагностика десятков разновидностей врожденных пороков развития у плода (пороки головного и спинного мозга, сердца, почек, печени, кишечника, конечностей, лицевых структур и др.). Раннее (до 12 недели беременности) выявление специфических признаков синдрома Дауна у плода. Кроме того - уточнение: характера беременности (маточная/ внематочная); количества плодов в матке; возраста плода (срока беременности); наличия отставания в развитии плода; положения плода в матке (головное или тазовое предлежание); характера сердцебиения плода; пола плода; расположения и состояния плаценты; состояния околоплодных вод; нарушений кровотока в сосудах плаценты; тонуса маточной мускулатуры (диагностика угрозы прерывания беременности). |
Потенциальное вредное воздействие УЗ-сканирования на организм плода гораздо меньше вредного воздействия рентгеновского излучения (группа экспертов ВОЗ официально признала безопасным четырехкратное УЗИ плода во время беременности). |
Технические ограничения и относительная субъективность интерпретации результатов сканирования. Диагностическая ценность УЗ-скрининга может существенно снижаться при слабых технических возможностях аппарата и низкой квалификации специалиста. |
|
Сортинг фетальных клеток |
Между 8-й и 20-й неделями беременности. |
Аналогичны таковым для биопсии хориона, плацентоцентеза и кордоцентеза. |
Эритробласты или лимфоциты плода, содержащиеся в венозной крови беременной женщины. |
Для сортинга (отделения плодных клеток, содержащихся в крови женщины, от ее собственных клеток) используют высокоспецифичные моноклональные антитела и проточный лазерный сортинг. Полученные клетки плода подвергают молекулярногенетическим исследованиям. |
Практически аналогичны возможностям биопсии хориона, плацентоцентеза и кордоцентеза |
Перенебрежимо низкий риск осложнений для плода, обусловленный малой инвазивностью процедуры в сочетании с диагностическими возможностями, идентичными таковым при высоко инвазивных манипуляциях (биопсия хориона и др.) |
Большая трудои техноемкость метода, приводящая к высокой себестоимости исследования. Недостаточная проверенность в плане надежности - данная методика в настоящее время преимущественно носит статус экспериментальной и в рутинной практике используется крайне редко. |
|
ИНВАЗИВНЫЕ МЕТОДЫ ПРЕНАТАЛЬНОЙ ДИАГНОСТИКИ |
|||||||
|
Название метода |
Сроки беременности |
Показания к проведению |
Объект исследования |
Методика проведения |
Возможности метода |
Достоинства метода |
Недостатки метода, риск при проведении процедуры |
|
Биопсия хориона |
10-11 недель. |
Высокая вероятность наследственных заболеваний (вероятность обнаружения тяжелой болезни у плода, сопоставимая с риском выкидыша после биопсии). |
Клетки хориона (наружной зароды- шевой оболочки). |
1 способ. Небольшое количество хориональной ткани отсасывается шприцем через катетер, введенный в канал шейки матки. 2 способ. Образец ткани засасывают в шприц с помощью длинной иглы, введенной в полость матки через брюшную стенку. Оба варианта биопсии хориона проводятся амбулаторно или с кратковременной госпитализацией беременной женщины. Манипуляция выполняется под УЗ-контролем. В зависимости от практики, принятой в конкретном медучреждении, биопсию выполняют либо под местным, либо под общим обезболиванием (наркозом). Перед процедурой женщине необходимо пройти лабораторное обследование (анализы крови, мазки и проч.). |
Определение у плода синдрома Дауна, синдромов Эдвардса, Патау и других хромосомных болезней, сопровождающихся грубыми уродствами или умственной отсталостью. Диагностика генных заболеваний (спектр диагностируемых наследственных болезней зависит от возможностей конкретной лаборатории и может варьировать от единичных генетических синдромов до десятков разных инвалидизирующих болезней). Определение пола плода. Установление биологического родства (отцовства). |
Быстрое получение результатов (в течение 3-4 дней после взятия материала). Диагностировать тяжелую инвалидизирующую болезнь у плода можно в период до 12-й недели, когда прерывание беременности происходит с меньшим количеством осложнений для женщины, к тому же уменьшается стрессовая нагрузка на членов семьи. |
По ряду технических причин не всегда удается провести качественный анализ образцов ткани. Существует незначительный риск получения ложноположитель- ных и ложноотрицательных результатов из-за феномена т. н. «плацентарного мозаицизма» (неидентичности генома клеток хориона и эмбриона). Длительное воздействие на плод ультразвука, безвредность которого не доказана. Риск случайного повреждения плодного пузыря. Риск неблагоприятного влияния на течение беременности при резус-конфликте. Риск выкидыша (от 2 до 6% в зависимости от состояния женщины). Риск инфицирования плода (1-2%). Риск кровотечения у женщины (1-2%). Риск (менее 1%) некоторых отклонений в развитии плода: описаны случаи грубых уродств конечностей у новорожденных, подвергавшихся биопсии хориона. В целом риск осложнений при биопсии хориона низок (не выше 2%). |
|
Плацентоцентез (поздняя биопсия хориона) |
II триместр беременности. |
Аналогичны показаниям к проведению биопсии хориона. |
Клетки плаценты. |
Аналогична методике описанного выше 2-го способа биопсии хориона. Проводится под местным или общим обезболиванием, амбулаторно или с кратковременной госпитализацией женщины. Требования по обследованию беременной перед плацентоцентезом идентичны таковым при биопсии хориона. |
Аналогичны возможностям биопсии хориона. |
Культивирование полученных при плацентоцентезе клеток может оказаться менее результативным, чем культивирование клеток хориона, поэтому иногда (очень редко) возникает потребность в повторении процедуры. Этот риск отсутствует в лабораториях, практикующих современные методы цитогенетической диагностики. Проведение обследования на достаточно большом сроке беременности (в случае обнаружения серьезной патологии прерывание беременности в этот период требует длительной госпитализации и чревато осложнениями). |
|
|
Амниоцентез |
15-16 недель. |
Те же, что при биопсии хориона и плацентоцентезе. Подозрение на наличие у плода некоторых врожденных заболеваний и патологических состояний. |
Околоплодная жидкость и находящиеся в ней клетки плода (слущенные клетки кожи плода, эпителиоциты из мочевыводящих путей и т.д.). |
Околоплодная жидкость набирается в шприц с помощью иглы, введенной в полость матки через брюшную стенку. Манипуляция производится под контролем УЗ-аппарата, амбулаторно или с кратковременной госпитализацией. Чаще применяют местную анестезию, но вполне возможно и проведение процедуры под общим наркозом. Перед процедурой беременная женщина проходит лабораторное обследование, аналогичное таковому при биопсии хориона и плацентоцентезе. |
Диагностика различных хромосомных и генных болезней. Определение степени зрелости легких плода. Определение степени кислородного голодания плода. Определение тяжести резус-конфликта между матерью и плодом. Диагностика некоторых пороков развития плода (например, грубых уродств головного и спинного мозга анэнцефалии, экзэнцефалии, спинномозговой грыжи и т.д.). |
Более широкий (в сравнении с биопсией хориона и другими инвазивными методами пренатальной диагностики) спектр выявляемых патологий. Риск выкидыша несколько меньше, чем при биопсии хориона. Этот риск всего на 0,5-1% выше, чем у беременных, которым вообще не проводились инвазивные обследования. |
Технологические проблемы. Поскольку клеток плода в забранном образце очень мало, необходимо дать им возможность размножиться в искусственных условиях. Для этого требуются особые питательные среды, определенная температура, реактивы, сложное оборудование. Достаточно долгое время (от 2 до 6 недель) проведения анализа хромосом. Результаты получают в среднем к 20-22 неделе. При подтверждении диагноза прерывание беременности на таком сроке сопровождается большим количеством осложнений, чем, например, на 12-й неделе. Сильнее и моральная травма членов семьи 1 . Длительное воздействие на плод ультразвука, безвредность которого не доказана. Несколько повышается риск рождения маловесного ребенка. Есть слабый (менее 1%) риск дыхательных расстройств у новорожденного. |
|
Кордоцентез |
После 18-й недели беременности. |
Аналогичны таковым при биопсии хориона и плацентоцентезе. |
Пуповинная кровь плода. |
Образец крови плода получают из вены пуповины, которую под контролем УЗИ пунктируют иглой, введенной в полость матки через прокол передней брюшной стенки женщины. Процедура выполняется под местным либо общим обезболиванием, амбулаторно или с кратковременной госпитализацией женщины. Требования по обследованию женщины перед кордоцентезом идентичны таковым при биопсии хориона. |
Аналогичны возможностям биопсии хориона и плацентоцентеза, частично амниоцентеза. Возможность лечебных манипуляций (введение лекарственных средств и т.п.). |
Минимальная вероятность осложнений. |
Проведение обследования на большом сроке беременности (в случае обнаружения серьезной патологии прерывание беременности в этот период требует длительной госпитализации и чревато осложнениями). |
Массовое обследование новорождённых (неонатальный скрининг ) - один из эффективных способов выявления наиболее распространенных врождённых и наследственных заболеваний у новорождённых детей.
Позволяет обеспечить раннее выявление заболеваний и их своевременное лечение, остановить развитие тяжёлых проявлений заболеваний (фенилкетонурии, муковисцидоза, врождённого гипотиреоза, адреногенитального синдрома, галактоземии ), ведущих к инвалидизации.
В рамках реализации приоритетного национального проекта «Здоровье» (приказ Минздравсоцразвития России от 22.03.2006 г. № 185 «О массовом обследовании новорождённых детей на наследственные заболевания») с 2006 года в неонатальный скрининг начато внедрение диагностики таких заболеваний, как адреногенитальный синдром, галактоземия и муковисцидоз.
С 2007 года в перечень выявляемых заболеваний включён аудиологический скрининг детей первого года жизни, который позволит своевременно провести диагностику нарушений слуха у ребёнка и последующую реабилитацию тугоухости.
С 2012 года в Свердловской области неонатальный скрининг расширен до 16 заболеваний (приказ МЗ СО от 02.03.2012 г. № 166-п «О совершенствовании массового обследования новорожденных детей на наследственные заболевания на территории Свердловской области»). Исследование проводится в сухом пятне крови методом тандемной масс-спектрометрии (MS-MS). Список дополнительных 11 заболеваний:
лейциноз
тирозинемия (тип 1)
цитруллинемия
множественная карбоксилазная недостаточность
недостаточность очень длинных цепей ацил-СоА-дегидрогеназы жирных кислот
недостаточность средний цепей ацил-СоА-дегидрогеназы жирных кислот
недостаточность митохондриального трифункционального белка/ недостаточность длинных цепей гидроксил-СоА-дегидрогеназы жирных кислот
глютаровая ацидурия (тип 1)
изовалериановая ацидемия
метилмалоновая ацидемия
пропионовая ацидемия
При выборе заболеваний для неонатального скрининга, в соответствии с рекомендациями Всемирной организации здравоохранения, учитывались такие факторы, как тяжесть проявления заболеваний, частота распространения данных заболеваний, а также простота и достоверность применяемых методов диагностики, наличие доступных и эффективных средств лечения.
В США массовый неонатальный скрининг проводится с 1963 года.
Неонатальный скрининг проводят на: - 4 день жизни у доношенного ребенка; - 7 день жизни у недоношенного ребенка.
Образец крови берут из пятки новорожденного ребенка через 3 часа после кормления. Забор образцов крови осуществляется на специальные фильтровальные бумажные тест-бланки из пятки новорожденного. Перед забором образца крови пятку новорожденного ребенка необходимо вымыть, протереть стерильной салфеткой, смоченной 70-градусным спиртом, затем смокнуть сухой стерильной салфеткой. Прокол пятки новорожденного ребенка осуществляется одноразовым скарификатором, первая капля крови снимается стерильным сухим тампоном. Для накопления второй капли крови, осуществляют мягкое надавливание на пятку новорожденного ребенка. Тест-бланк прикладывается перпендикулярно и пропитывается кровью полностью и насквозь в соответствии с указанными на тест-бланке размерами круга. Вид пятен крови должен быть одинаковым с обеих сторон тест-бланка.
Гипотиреоз . Патология щитовидной железы, которая может привести к отставанию в физическом и психическом развитии. На сегодняшний день своевременно диагностированный гипотиреоз хорошо поддается гормональной терапии. Распространенность заболевания - 1 случай из 5 тысяч. Андрогенитальный синдром. Патология коры надпочечников, при которой нарушается нормальная выработка гормона кортизола. Может проявиться в виде задержки развития половой системы, проблем с сосудами и сердцем. Полному излечению этот синдром не поддается, но его можно держать под контролем при помощи гормональной терапии. Распространенность заболевания - 1 случай из 15 тысяч.
Муковисцидоз . Заболевание проявляется заметным сгущением секрета в пищеварительном тракте и легких, что приводит к поражениям печени, ЖКТ, дыхательной системы и других органов. Поддается лечению. Распространенность заболевания - 1 случай из 3 тысяч.
Фенилкетонурия . Заболевание, которое характеризуется нарушением выработки определенных ферментов. Последствия достаточно тяжелые. В первую очередь к ним относятся поражения ЦНС. Однако их можно избежать при помощи специальной диеты. Распространенность заболевания - 1 случай из 15 тысяч.
Галактоземия . Так называют недостаток фермента, расщепляющего галактозу - один из сахаров, который содержится в лактозе и иных веществах. Последствия нехватки этого фермента проявляются через несколько недель жизни. У ребенка начинается желтуха, рвота, потеря аппетита. Со временем развиваются тяжелые патологии печени, замедляется умственное и физическое развитие, ухудшается зрение. Эта врожденная патология опасна, при этом встречается достаточно редко. Распространенность - 1 случай из 30 тысяч.
Прогноз потомства, осуществляемый в медико-генетической консультации, является вероятностным и не позволяет ответить однозначно, завершится ли данная беременность рождением здорового или больного ребенка. Эффективность медико-генетического консультирования значительно повышается с применением современных методов дородовой диагностики, которые не только позволяют определить заболевание задолго до рождения ребенка, но и прервать беременность при поражении плода в I или II триместре. Своевременное прерывание беременности необходимо при таких наследственных болезнях и врожденных пороках, лечение которых на современном этапе не дает должных результатов или при которых изменения в организме, возникшие в период внутриутробного развития, необратимы (болезни накопления, ахондроплазия, анэнцефалия и др.).
Основными показаниями для проведения пренатальной диагностики являются:
· наличие в семье точно установленного наследственного заболевания;
· возраст будущей матери старше 35 лет, отца - старше 40 лет;
· наличие матери Х-сцепленного рецессивного патологическою гена;
· беременные, имеющие в анамнезе спонтанные аборты, мертворождения
· неясного генеза, детей с множественными врожденными пороками развития и с хромосомной патологией;
· наличие структурных перестроек хромосом (особенно транслокаций и инверсий) у одного из родителей;
· гетерозиготность обоих родителей по одной паре аллелей при аутосомно-рецессивных заболеваниях;
· беременные из зоны повышенного радиационного фона, с тератогенным воздействием и др.
К основным методам пренатальной диагностики относятся: ультразвуковое исследование (УЗИ), амниоцентез, биопсия хориона, фетоскопия, определение альфа-фетопротеияа.
Из всех методов пренатальной диагностики наиболее распространено ультразвуковое исследование плода (эхография). Метод основан на способности ультразвуковой волны отражаться от поверхности раздела двух сред, отличающихся различной плотностью, что позволяет получить их изображение на экране электронно-лучевой трубки. Это исследование проводится всем беременным женщинам трехкратно на 14-16-й, 20-21-й и 26-27-й неделях беременности. Женщин из группы риска по рождению детей с пороками развития осматривают в более ранние сроки.
С помощью ультразвукового исследования можно диагностировать грубые пороки мозга (анэнцефалию, гидроцефалию, черепно- и спинномозговые грыжи, микроцефалии); пороки конечностей (отсутствие конечности или ее части, системные скелетные дисплазии); пороки почек (агенезию или гипоплазию почек, гидронефроз, поликистоз), атрезии желудочно-кишечного тракта, пуповинньге и диафрагмальные грыжи, некоторые врожденные пороки сердца.
Следует отметить, что разные формы пороков диагностируют в разные сроки беременности. Если анэнцефалия может быть распознана уже на 14- 16-й неделе, то для диагностики гидронефроза необходимо исследование в значительно более поздние сроки беременности. Одни пороки развития (черепно-мозговые грыжи) могут быть выявлены уже при однократном исследовании, другие (микроцефалия, некоторые формы скелетных дисплазий) диагностируются лишь при динамическом наблюдении.
Если у плода при ультразвуковом исследовании выявляется несовместимый с жизнью порок развития, то беременность прерывают. Этот метод пренатальной диагностики практически безопасен как для матери, так и для плода.
Большое распространение получил метод определения альфа-фетопротеина (АФП) в сыворотке крови беременной или в амниотической жидкости. АФП-кислый гликопротеид продуцируется печенью плода. Оптимальным сроком определения АФП в сыворотке крови матери является 15-16-я неделя беременности. При выявлении изменений в уровне данного гликопротеида повторное исследование проводят через 2-3 недели.
Уровень АФП повышается при ряде аномалий развития плода, таких как спинномозговые грыжи, анэнцефалия, гидроцефалия, врожденный нефроз, спонтанная внутриутробная гибель плода, при угрозах выкидыша, атрезиях пищевода и двенадцатиперстной кишки и др. Снижение концентрации АФП отмечается при хромосомной патологии (синдром Дауна, Эдвардса и др.). Необходимо помнить, что уровень АФП в крови беременной может быть повышен и при заболеваниях матери: опухолях печени, тератокарциноме яичников, хроническом гепатите, циррозе и др.
Амниоцентез с цитогенетическим или биохимическим исследованием амниотической жидкости имеет важное значение в диагностике наследственных заболеваний обмена веществ, хромосомной патологии и определении пола плода при гетерозиготном носительстве матери Х-сцепленного рецессивного гена. Амниоцентез проводят под контролем ультразвукового исследования, с помощью которого точно определяют локализацию плаценты. Пункцию амниона производят трансабдоминально, реже трансвагинально и извлекают шприцем около 10-15 мл жидкости. Оптимальный срок для проведения амниоцентеза - 14-16-я неделя беременности, когда накапливается достаточное количество амниотической жидкости и в ней увеличивается количество клеток. Необходимо помнить, что при проведении амниоцентеза возможны осложнения со стороны плода или матери. Наиболее серьезное - гибель плода вследствие разрыва плодного пузыря с последующим спонтанным абортом. Очень редкое - инфицирование полости матки, приводящее к амниониту и выкидышу. Поскольку амниоцентез представляет хотя и небольшую, но все-таки операцию, для его проведения необходимо получить согласие женщины.
Фетоскопия (амниоскопия) - это метод визуального наблюдения плода в полости матки через эластический зонд, оснащенный оптической системой. Оптимальный срок исследования - 18-22-я неделя беременности. Этот метод применяется для диагностики видимых врожденных пороков конечностей, лица (расщелины), ахондроплазии, а также для выявления ихтиоза, буллезного эпидермолиза путем биопсии кожи плода.
Перспективным методом пренатальной диагностики, позволяющим начинать исследование плода в более ранние сроки, является биопсия хориона. Ее проводят обычно на 7-9-й неделе беременности. Ворсинки берут биопсийными щипцами с помощью специального гибкого катетера, вводимого через шейку матки. В дальнейшем их исследуют с помощью цитогенетических и биохимических методов, как при амниоцентезе. При выявлении наследственного заболевания у плода беременность прерывают в первом триместре. Недостатком данного метода является сравнительно более высокая частота выкидышей после взятия биопсии ворсин хориона.
Методы дородовой диагностики с каждым годом совершенствуются. В настоящее время применяется «ранний» амниоцентез, проводимый на 11- 13-й неделе беременности (здесь для анализа берут лишь 1-2 мл околоплодной жидкости), плацентоцентез (получение ворсин плаценты во II триместре беременности); хордоцентез, позволяющий получить пуповинную кровь плода.
Современные методы пренатальной диагностики основаны на молекулярно-генетических подходах. Используя пробы, комплементарные к тем или иным участкам ДНК, удается установить, не является ли данный плод гетерозиготой или гомозиготой по патологическому гену. При этом используются два подхода: непосредственное определение наличия или отсутствия патологического гена (что возможно, когда известно строение гена) или выявление каких-либо других полиморфных участков ДНК (на которые есть зонды), тесно сцепленных с искомым геном неизвестного строения.
В настоящее время пренатальная диагностика при медико-генетическом консультировании семей нашла широкое применение, постоянно увеличивается число распознаваемых наследственных болезней и врожденных пороков развития. Таким образом, выполняется одна из главных задач современной медицинской генетики - предупреждение рождения детей с тяжелой наследственной или врожденной патологией.
Глава IX
Значение знаний генетики для практической медицины
Факты пренатальной диагностики
Большинство детей рождаются генетически и клинически здоровыми.
По данным Европейского регистра врожденных пороков развития частота аномалий развития в пренатальном периоде не превышает 2,5-3%.
Хромосомные аномалии (ХА) у новорожденных регистрируется только в 7-8 случаев на 1000, т.е. менее чем в 1%.
Частота грубой патологии хромосом - хромосомных синдромов (в основном трисомий) — 2-3 случая на 1000. Среди детей, родившихся со стигмами дизэмбриогенеза — 12%.
По данным ВОЗ, только 4-6% новорожденных страдают ВНЗ.
Лишь 2% ВПР являются следствием воздействия на беременную медикаментов, вредных веществ, рентгеновского облучения или вирусов, в 98% всех случаев формирование ВПР обусловлено случайными мутациями и наследственностью родителей.
Непосредственными причинами ВПР в 15-20% случаев являются наследственные (генетические) факторы, в 8-10% — факторы внешней среды или заболевания матери (диабет), в 65% всех случаев причины ВПР остаются неизвестными.
В то же время:
Врожденные пороки развития плода в большинстве регионов России занимает лидирующее место в структуре основных причин перинатальной смертности;
Показатели младенческой смертности от ВПР по Москве и Московской области варьируют от 4,3 до 5,0%;
До 5-7% мертворождений обусловлены ВНЗ, а их удельный вес в структуре причин младенческой смертности достигает 20-25%;
Выжившие дети, как правило, становятся глубокими инвалидами, лечение, особый уход, воспитание и социальная адаптация которых требует значительных усилий от семьи и государства, больших экономических затрат;
Выявляемость ВПР остается низкой: по данным Европейского регистра врожденных пороков развития частота ВПР у новорожденных составляет в среднем 21,8 на 1000, а частота выявляемых антенатально - 5,8 на 1000. По данным разных авторов, показатели частоты дородового выявления ВПР варьируют в широких пределах - от 0,14% до 2,53%.
Методы исследования
Ультразвуковые (скрининговые и селективные).
Биохимические (определение уровней сывороточных маркеров крови).
Инвазивные (аспирация ворсин хориона, амниоцентез, кордоцентез, плацентоцентез).
Методы лабораторной генетики (цитогенетика, молекулярная генетика и т.д.).
Фунциональная оценка состояния плода (КТГ, допплерометрия).
Методы верификации диагноза (паталогоанатомические и синдромологические исследования).
Ультразвуковое исследование.
Среди всех современных методов пренатальной диагностики УЗИ занимает первое место в связи с уникальным сочетанием качеств: высокой информативностью, безопасностью и возможностью массового использования.
Безопасность:
В диагностических приборах используется ультразвук интенсивностью в пределах 1-40 милливатт/см2;
Повреждение тканей наступает при интенсивности ультразвука 4 ватт/см2, а используемая в клинической практике интенсивность ультразвука по своей энергии примерно в 100-1000 раз меньше этого уровня;
Ввиду пульсирующего режима излучения время воздействия ультразвука составляет менее 1% времени всего исследования;
В настоящее время нет ни одного официального подтвержденного сообщения о вредном влиянии УЗИ на развитие плода.
Важно подчеркнуть:
1. Тщательная оценка анатомии плода, соотношений размеров отдельных частей его тела и органов позволяют выявить ВПР в 60-70% случаев.
2. Эффективность УЗ-диагностики ВПР плода повышается при использовании двухуровневого обследования беременных.
I уровень - скрининг беременных в женских консультациях, родильных домах.
II уровень - диагностические центры, отделения пренатальной диагностики региональных центров. В эти учреждения направляются беременные с подозрением на ВПР после обследования на I уровне.
3. Ультразвуковая диагностика ВПР возможна в I триместре беременности.
4. Задача ранней диагностики ВПР пока не может быть эффективно решена в рамках практического здравоохранения. Основная цель при проведении УЗИ в I триместре состоит в формировании группы риска по ВНЗ.
Ультразвуковое исследование в I триместре
1. Позволяет максимально точно установить срок беременности путём измерения копчико-теменного размера (КТР) эмбриона/плода.
2. Точность диагностики достигается проведением УЗИ трансвагинальным датчиком с частотой не менее 5-7,5 МГц.
3. Детали всех органов и анатомических структур в эти сроки неразличимы, поэтому рекомендуется давать оценку следующим анатомическим образованиям:
Кости свода черепа: оценка костей черепа позволяет выявить такие пороки как акрания, экэнцефалия, анэнцефалия, инионцефалия, черепно-мозговая грыжа;
Сосудистая система боковых желудочков мозга в виде “бабочки”: отчётливое М-эхо и картина “бабочки” позволяет уже в ранние сроки беременности заподозрить многие тяжелые пороки головного мозга - прозэнцефалию, голопрозэнцефалию, ателэнцефалию;
Позвоночник: возможно выявление spina bifida;
Желудок: можно заподозрить атрезию пищевода;
Передняя брюшная стенка: можно диагностировать гастрошизис, омфалоцеле (не путать с физиологической пупочной грыжей, наблюдающейся до 12 недель!);
Мочевой пузырь: можно диагностировать мегацистик;
Кости конечностей: выявить фокомелию.
4. Оценка структур плодного яйца и эмбриона используется в качестве критерия отбора в группу риска по хромосомной патологии плода:
Толщина воротникового пространства (ТВП) 3 и более мм в сроке 10 -14 недель является маркером не только ХА (синдромы Дауна, Тернера, Эдвардса), но и широкого спектра различных ВПР (сердца, опорно-двигательного аппарата) и других осложнений беременности (самопроизвольные аборты, внутриутробная гибель плода, ранняя неонательная смертность);
Диаметр желточного мешка: при аномальных значениях диаметра: более 6,4 мм в сроке 10 -11 недель, деформации его структуры и повышенной эхогенности, или отсутствия вероятность неразвивающейся беременности значительно возрастает;
Сердечная деятельность эмбриона: в норме средние значения ЧСС составляют 170 уд/мин в 10 недель, и 157 уд/мин в 14 недель беременности. Учащение и, особенно, замедление ритма в эти сроки являются показанием для динамического наблюдения за беременной.
Ультразвуковое исследование во II триместре
1. Выявление ВПР при УЗИ: наиболее оптимальными сроками необходимо считать 20-24 недели.
2. Оценка развития плода обязательно должна включать измерение основных фетометрических параметров: бипариетальный и лобно-затылочный размеры (БПР и ЛЗР), окружность головки и живота (ОГ и ОЖ), длину бедра (ДБ) плода:
Все фетометрические параметры, изложенные в многочисленных таблицах и существующие в программах ультразвуковых приборов, соответствуют сроку беременности, рассчитанному по дате последней нормальной менструации;
Чаще всего используются фетометрические таблицы F.Hadlock, M.Hansmann и S.Campbell. В настоящее время во многих регионах России и в Ярославской области разработаны собственные нормативные параметры фетометрии;
Применение региональных нормативов (см. приложение) фетометрических показателей размеров частей тела плода и его массы позволяет стандартизировать результаты пренатального обследования, обеспечить правильную оценку динамики роста плода, уменьшить число ошибочных диагнозов ВЗРП.
Диагностика ВПР
1. Изучение анатомии плода важно проводить последовательно по единой схеме (голова, лицо, позвоночник, легкие, сердце, органы брюшной полости, почки и мочевой пузырь, конечности).
2. Некоторые ВПР в начале II триместра еще не выявляются при УЗИ (синдром Денди-Уокера, некоторые формы гидроцефалии, аневризма вены Галена, арахноидальные и порэнцефалические кисты) и могут быть диагностированы только в III триместре, что требует дополнительного УЗИ в эти сроки.
Пороки центральной нервной системы
Аномалии развития ЦНС являются наиболее часто выявляемыми ВПР.
Частота колеблется от 1:1000 живорожденных (гидроцефалия), до 1:25000-35000 живорожденных (синдром Денди-Уокера).
К основным врожденным порокам ЦНС относятся: анэнцефалия, цефалоцеле, гидроцефалия и вентрикуломегалия, микроцефалия, агенезия мозолистого тела, кисты сосудистого сплетения, голопрозэнцефалия, spina bifida.
Анэнцефалию и акранию можно выявить уже в I триместре. Анэнцефалия устанавливается по отсутствию костей мозгового черепа и ткани головного мозга. Акрания - когда мозг плода не окружен костным сводом. Анэнцефалия и акрания являются пороками развития, несовместимыми с жизнью.
Цефалоцеле встречается с частотой 1:2000 живорожденных и представляет собой выход мозговых оболочек наружу через дефект костей черепа. Термин энцефалоцеле означает, что в состав грыжевого мешка входит мозговая ткань. При УЗИ цефалоцеле определяется как грыжевое образование, предлежащее к костям черепа. Прогноз для жизни и здоровья ребёнка неблагоприятный, рекомендуется прерывание беременности.
Spina bifida - это аномалия развития позвоночного столба, возникающая в результате нарушения процесса закрытия нервной трубки. Выход через дефект оболочек спинного мозга называется менингоцеле. Если грыжевой мешок содержит нервную ткань, образование носит название менингомиелоцеле. Чаще дефект расположен в поясничном и крестцовом отделах позвоночника. Частота зависит от географического региона: в Великобритании 4:1000, в США 0,5:1000 новорожденных. УЗ-диагностика возможна с конца I триместра. При наличии spina bifida остистые отростки позвонков при поперечном сканировании не смыкаются, а образуют U- или Y-образную конфигурацию. При наличии менингоцеле или менингомиелоцеле в области дефекта определяется тонкостенный грыжевой мешок. Может быть изолированной аномалией, но часто сочетается с синдромом Арнольда-Киари, а также более чем с 40 синдромами множественных пороков развития. Отмечается возрастание этой патологии при монозиготных двойнях. Тактика. В случае обнаружения менингомиелоцеле до периода жизнеспособности плода, рекомендуется прерывание беременности. При изолированной spina bifida возможно хирургическое вмешательство после родов (закрытие дефекта или шунтирование). Любой открытый дефект нервной трубки должен быть закрыт в течение 24 часов жизни (риск инфекции). Прогноз для жизни и здоровья зависит от уровня расположения, величины и характера сочетанных аномалий.
Дефекты нервной трубки - термин, объединяющий все вышеперечисленные аномалии развития ЦНС. Частота составляет от 1-2:1000 до 6:1000 новорожденных, и зависит от места проживания, времени года на момент зачатия и факта приёма противосудорожных препаратов, как матерью, так и отцом ребёнка. Большинство пороков встречается у женщин, не имеющих факторов риска.
Вероятность повторения данного вида ВПР у потомства составляет:
4-5% при рождении одного ребёнка с ВПР
10% при рождении двух детей с ВПР
3-5% при наличии ВПР у одного родственника первой линии
5-7% при наличии ВПР у двух родственников первой линии
10% при наличии двух последовательных анализов альфа-фетопротеина в сыворотке матери со значениями выше 2,5 МоМ (превышение значения средней)
Гидроцефалия - увеличение размеров желудочков мозга, в большинстве случаев сопровождается увеличением размеров головы. Вентрикуломегалия - изолированное расширение желудочков мозга, которое не сопровождается увеличением размеров головы. В большинстве случаев развивается в результате нарушения оттока спиномозговой жидкости.Хромосомные дефекты обнаружены в 25% случаев гидроцефалии, выявленных до родов. Сочетанные аномалии диагностируются в 70-80% наблюдений, при этом половина из них являются экстракраниальными и не всегда могут быть выявлены пренатально:
Менингоэнцефалоцеле с формированием синдрома Арнольда-Киари, который встречается у 1/3 плодов с гидроцефалией;
Синдром Денди-Уокера (частичная или полная агенезия мозжечка, кистозное расширение IV желудочка и увеличение задней черепной ямки);
Голопрозэнцефалия (нарушение деления мозга на полушария);
Агенезия мозолистого тела;
Арахноидальные кисты;
Аневризма вены Галена.
Тактика: при выявлении гидроцефалии до периода жизнеспособности плода целесообразно с родителями обсудить вопрос о прерывании беременности. Если беременность не была прервана, в дальнейшем, при нарастании вентрикуломегалии, возможно проведение шунтирования. Эффективность шунтирования и исход операции зависят от наличия сочетанной патологии.
Микроцефалия встречается с частотой 1,6:1000 живорожденных и может быть первичной, а также входить в состав различных синдромов: энцефалоцеле и spina bifida. Микроцефалия описана более чем при 125 ХА, 400 моногенных заболеваниях. К факторам способствующим формированию микроцефалии, относятся также инфекции(цитомегаловирус, токсоплазмоз, краснуха), алкоголь, ретиновая кислота, кокаин и фенилкетонурия у матери.
Диагноз, основанный только на значениях бипариетального размера, недостоверен, необходима оценка уменьшения размеров головы по отношению к длине бедренной кости и/или сроку беременности на 3 недели и более без каких либо отклонений от нормального развития отдельных структур мозга. Прогноз для жизни и здоровья зависит от причины аномалии.
Кисты сосудистого сплетения боковых желудочков во втором триместре встречаются у 1-2% беременных, чаще в сроки от 14 до 24 недель. Диаметр кист, как правило, не превышает 10 мм. При наличии кист необходимо тщательно изучить анатомию плода. При наличии аномалий показано пренатальное кариотипирование. При единичных изолированных кистах тактика ведения беременности особенностей не имеет. У большинства плодов кисты сосудистого сплетения спонтанно исчезают к 28-30 неделям беременности.
Важно помнить:
Риск патологического кариотипа плода при изолированных кистах достигает 2,4% (трисомия 18);
Риск анеуплоидии плода выше при двусторонних кистах;
Вероятность патологического кариотипа достигает 10,5% при сочетании кист с дополнительными факторами риска: возраст матери, ВПР, выявленные при УЗИ, отягощённый акушерский и семейный анамнез. Рекомендуется амниоцентез и кариотипирование плода.
Агенезия мозолистого тела, полная или частичная, встречается от 0,4 до 0,7% всех беременностей. Частота анеуплоидии плода — 10%. Агенезия мозолистого тела возможна при более, чем 40 хромосомных аберрациях, 120 моногенных заболеваниях и синдромах, сопровождающихся пороками развития. С агенезией наиболее часто сочетаются голопрозэнцефалия, синдромы Денди-Уокера и Арнольда-Киари. Диагностика до 20 недель беременности практически невозможна.
2. При изучении анатомии головного мозга, размеров и формы головки плода, важно уделять внимание визуализации лица плода:
Оценка профиля позволяет диагностировать ряд пороков (двухсторонняя или большая срединная расщелина лица) и выявить эхографические маркеры ХА (сглаженный профиль, уменьшение длины костей носа, микрогения);
Изучение носогубного треугольника позволяет диагностировать или заподозрить наличие расщелин губы и неба, которые визуализируются как гипо- или анэхогенные дефекты;
Четкая визуализация глазниц необходима для исключения анофтальмии, микрофтальмии, циклопии, новообразований.
1. Наиболее оптимальными сроками для исследования анатомии сердца плода считаются 24-26 недель беременности. При проведении УЗИ в сроки меньшие оптимальных и невозможности четкой визуализации анатомических структур сердца, рекомендуется исследование повторить через 4 недели.
2. В настоящее время в обязательный скрининговый протокол входит только оценка 4-х камерного среза сердца плода. Любое отклонение от классического изображения 4-х камерного среза сердца должно быть поводом к направлению пациентки в диагностический центр пренатальной диагностики (II уровень) для расширенной эхокардиографии с обязательным использованием метода Доплера.
3. Соблюдение определенной очередности в этапах оценки сердца плода позволяет провести качественное эхокардиографическое исследование и выявить от 60% до 80% ВПС.
Занимает ли сердце плода нормальное расположение?
Нормальные ли размеры сердца?
Как располагается ось сердца?
Одинаковы ли размеры предсердий и желудочков?
Нет ли дефектов межжелудочковой перегородки?
Занимают ли атриовентрикулярные клапаны нормальное положение?
Нет ли изменений эндокарда, миокарда, перикарда?
5. При выявлении ВПС плода показано исследование его кариотипа, так как у 30% таких плодов возможна анеуплоидия. Риск ХА возрастает до 50% при сочетании ВПС с другими ВПР.
6. У плодов с нарушениями ритма сердца существует высокий риск ВПС: при суправентрикулярной тахиардии-10%, при нарушениях ритма желудочков-1-2%, при полной блокаде-50-60%.
Для повышения качества эхокардиографического исследования плода, помимо изучения 4-х камерного среза, целесообразно использовать в практике срез через 3 сосуда, включающий изображение 3-х главных сосудов — легочного ствола, восходящей аорты и верхней полой вены. При этом продолжительность УЗИ плода увеличивается не более, чем на 40-50 сек. Особое внимание должно уделяться оценке размеров сосудов и их взаимного расположения. Любая диспропорция свидетельствует о патологии:
Гипоплазия левых отделов сердца - легочный ствол значительно расширен, диаметр аорты значительно уменьшен;
Стеноз легочной артерии - резкое уменьшение размеров ствола легочной артерии, диаметр аорты и верхней полой вены в норме;
Коарктация аорты - уменьшение диаметра аорты при нормальном 4-х камерном срезе;
Общий артериальный ствол - визуализируются только 2 сосуда (собственно артериальный ствол и верхняя полая вена);
Транспозиция магистральных сосудов - наблюдается нарушение нормального взаиморасположения магистральных артерий: аорта смещается кпереди ствола легочной артерии и располагается правее от нее;
Тетрада Фалло - уменьшение диаметра ствола легочной артерии, расширение диаметра аорты и смещение ее кпереди от линии соединяющей легочный ствол и верхнюю полую вену.
Наиболее часто диагностируемые ВПС:
Дефект межжелудочковой перегородки (ДМЖП), малый (до 4 мм) и большой, составляет 20% всех ВПС. Может сочетаться с другими аномалиями, хромосомными дефектами: ДМЖП встречается при более чем 40 хромосомных дефектах, включающих трисомии 13,18 и 21, а также при более чем 90 синдромах множественных пороков развития. Частота малых, не приводящих к нарушению гемодинамики ДМЖП в её мышечной части достигает 53 случаев на 1000 живорожденных. Около 90% таких дефектов самостоятельно закрываются к 10 месяцам жизни и не оказывают влияния на прогноз для жизни и здоровья. Риск формирования ДМЖП у плода возрастает до 9,5% при наличии ДМЖП у матери.
ДИАГНОСТИКА:
Большинство малых ДМЖП не выявляются в ходе пренатального УЗИ.
Большинство (73%) ВПС у плода, не выявленых при УЗИ на I уровне, относятся к ДМЖП.
Цветовое допплеровское картирование (ЦДК) оказывает существенную помощь в диагностике ВПС.
Даже при больших дефектах ДМЖП заболевание может протекать бессимптомно до 2-8 недели жизни.
ТАКТИКА ВЕДЕНИЯ:
Выявление небольшого изолированного ДМЖП плода не требует изменения тактики ведения беременности и родов.
Ведение беременной согласуется с детскими кардиохирургами, с которыми обсуждается прогноз и возможности хирургического лечения.
В 50% случаев мелкие дефекты спонтанно закрываются в возрасте до 5 лет, 80% оставшихся — в подростковом возрасте.
Гипопластический синдром левых отделов сердца (ГСЛС) - спектр аномалий, характеризующихся недоразвитием левого желудочка с атрезией или выраженной гипоплазией митрального и/или аортального клапанов. Частота составляет 7-9% или четвертое место среди всех ВПС. Является наиболее частой причиной неонатальной смертности от врожденных пороков. Диагностика возможна при получении 4-х камерного среза, при этом визуализируются маленькие размеры левых отделов сердца в сравнении с обычными или увеличенными правыми отделами. Для исключения гипоплазии или атрезии необходимо оценить анатомию митрального и аортального клапанов. Оптимальный срок диагностики порока — 22-24 недели беременности. Прогноз. Дети с ГСЛС выживают редко: 15% новорожденных умирают в первые сутки, 70% — в первую неделю, и 91% — в первый месяц жизни. Оперативное лечение порока заключается в проведении многоэтапной операции (по Norwood), сопровождается высокой летальностью и не позволяет избежать тяжелой инвалидизации ребёнка.
Единственный желудочек сердца - тяжелый порок, при котором желудочки сердца представлены единой камерой в сочетании с общим атриовентрикулярным соединением, содержащим два клапана. Легко диагностируется при использовании стандартного 4-х камерного среза. Нередко сочетается с трисомией 18 и 21, синдромом Тернера. Выживаемость пациентов без оперативного лечения составляет 30%.
Аномалия Эбштейна - врожденный порок сердца при котором септальная и задняя створки трехстворчатого клапана развиваются непосредственно из эндокарда правого желудочка, что приводит к смещению клапана вглубь правого желудочка и разделению желудочка на два отдела: дистальный (подклапанный) - активный, и проксимальный (надклапанный) - пассивный. Надклапанный отдел, соединяясь с правым предсердием, формирует единое функциональное образование. Порок редко сочетается с хромосомными аберрациями и с синдромами множественных пороков развития. Частота аномалии Эбштейна составляет 0,5% от всех ВПС. Диагностика основывается на обнаружении значительно увеличенных правых отделов сердца за счет правого предсердия. Диагностируется при изучении 4-х камерного среза. Почти всегда сопровождается кардиомегалией. УЗ-диагностика возможна с 20 недель. Прогноз в основном зависит от выраженности анатомических изменений. Оперативное лечение показано пациентам с выраженными симптомами заболевания. После операции большинство пациентов остаются инвалидами I или II группы.
Тетрада Фалло - сложный порок, включающий несколько аномалий: дефект межжелудочковой перегородки, декстрапозицию аорты (аорта „наездник”), обструкцию выходного отдела легочной артерии и гипертрофию правого желудочка. У 30% новорожденных с тетрадой Фалло обнаруживаются экстракардиальные аномалии развития. Нередко сочетается с хромосомными аномалиями (трисомии 13, 18 и 21). Патологический кариотип может отмечаться в 18-22% случаев. Частота составляет от 4 до 11% от всех ВПС. Диагностировать порок при изучении 4-х камерного среза сердца плода очень трудно, и он часто пропускается при скрининговом исследовании, проведенном в сроках до 22 недель беременности. Необходимо обязательно использовать срезы через выходные отделы главных артерий и срез через 3 сосуда. Рекомендуется ЦДК. Прогноз для жизни во многом зависит от степени обструкции выходного тракта правого желудочка. Оперативное лечение порока возможно в любом возрасте. Уровень ранней смертности в случаях полной хирургической коррекции тетрады Фалло составляет менее 5%. В отдаленном периоде 80% пациентов чувствуют себя удовлетворительно и имеют нормальные функциональные показатели.
Транспозиция главных артерий - это порок сердца, при котором аорта или большая ее часть выходят из правого желудочка, а легочная артерия - из левого желудочка. Сочетанную экстракардиальную патологию имеют 8% новорожденных. Частота составляет 5-7% от всех ВПС. Диагностика возможна только при изучении 3-х сосудистого среза и срезов через магистральные сосуды: в норме главные артерии перекрещиваются, а при транспозиции выходят из желудочков параллельно: аорта - из правого желудочка, легочная артерия - из левого желудочка. Порок не совместим с жизнью.
Артериальный ствол - порок развития, при котором из сердца выходит один артериальный сосуд. При этом пороке всегда присутствует ДМЖП. У 30% новорожденных отмечаются крупные экстракардиальные пороки. Среди хромосомных аномалий описаны трисомии 13, 18 и 21, триплоидия и разнообразные делеции и дупликации. Аномальный кариотип выявляется у 17% плодов. Частота: встречается у 1- 4% пациентов с выявленными ВПС. Диагностика: 4-х камерный срез не позволяет диагностировать порок, необходимо использование среза через 3 сосуда. Полезным дополнением является ЦДК, позволяющее оценить функцию клапана артериального ствола. УЗ-диагностика возможна с 20 недель. Прогноз: порок летальный — при отсутствии оперативного лечения смерть может наступить в течение 1-6 месяцев жизни.
Стеноз и атрезия легочной артерии. Порок описан при многих ХА и при 60 синдромах множественных пороков развития. Аномальный кариотип выявляется у 33% плодов. Риск возникновения порока при наличии стеноза легочной артерии у матери составляет 4%. Частота: около 20% всех ВПС. Диагностика. При атрезии сосуд часто не виден или значительно уменьшен в диаметре, при стенозе часто отмечается постстенотическое расширение легочной артерии и небольшие размеры правого желудочка с гипертрофированными стенками. Если нет ДМЖП, то размеры правого желудочка и предсердия увеличиваются. Лечение. После рождения новорожденным с выраженными гемодинамическими нарушениями должна быть проведена баллонная пластика клапана или реконструктивная операция. Прогноз чаще благоприятный.
Стеноз аорты. Встречается при некоторых хромосомных аберрациях и наследственных болезнях (трисомии 13, 18 и синдром Тернера). Частота составляет 3-6% всех ВПС. Диагностика: при аортальном стенозе отмечается выраженное преобладание диаметра легочной артерии над аортой. Прогноз. Исход зависит от степени тяжести обструкции выходного тракта левого желудочка. Чаще требуется оперативное лечение (баллонная пластика, пластика по Norwood), т.к. стеноз с возрастом, как правило, прогрессирует.
Исследование легких плода
1. Изучение эхогенности лежит в основе оценки зрелости лёгких плода, которая проводится при сравнении эхоструктуры лёгких и его печени:
Если эхоструктура лёгких темнее печени — лёгкие считаются „незрелыми” (высокий риск СДР новорожденного);
Если эхоструктура лёгких и печени одинаковы - лёгкие считаются „дозревающими” (риск СДР 50%);
Если эхоструктура лёгких светлее печени - лёгкие считаются „зрелыми” (нет риска СДР).
2. Размеры: ширина и передне-задний размер измеряются в плоскости перпендикулярной оси позвоночника выше купола диафрагмы на 2-3 мм, а длина — по среднеключичной, аксиллярным или лопаточной линиям.
3. Оценка наличия в грудной полости свободной жидкости или патологических образований (диафрагмальные грыжи), а также особенностей расположения рёбер, что может помочь в диагностике аномалий костной системы. Среди ВПР наиболее часто диагностируется кистозно-аденоматозный порок развития легкого.
Исследование органов брюшной полости
1. Большинство пороков желудочно-кишечного тракта сочетаются с множественными пороками развития, хромосомными и наследственными заболеваниями (10-40%), поэтому при их выявлении рекомендуется пренатальное кариотипирование плода.
2. Обструктивные пороки ЖКТ чаще диагностируются только в конце второго, начале третьего триместров беременности. Почти всегда сопровождаются многоводием, часто требующим лечебного амниоцентеза для предупреждения преждевременных родов, и характерными признаками при УЗИ: отсутствие эхотени желудка, „двойной пузырь” (double bubble), множественные расширенные петли тонкого и толстого кишечника, гиперэхогенный кишечник.
Омфалоцеле - расширение пупочного кольца с образованием грыжевого мешка, содержащего органы брюшной полости. Сочетается с другими аномалиями и хромосомными дефектами в 70% случаев. ХА встречаются в 20% случаев. Частота: 1:3000-6000 новорожденных. Диагностика: визуализируется в виде округлого образования, непосредственно примыкающего к передней брюшной стенке, заполненного органами брюшной полости. Необходимо учитывать, что до 10-13 недель может наблюдаться физиологическая пупочная грыжа. Лечение - оперативное. При небольших размерах омфалоцеле операция проводится в один этап. Прогноз благоприятный при отсутствии сочетанных аномалий.
Гастрошизис - эвентерация органов брюшной полости (чаще кишечника) через дефект передней брюшной стенки (чаще справа от пупка). Чаще встречается изолированно (до 79%). Вероятность ХА — 10%. Частота порока составляет 1-7:10000 новорожденных. Диагностика основывается на визуализации при УЗИ петель кишечника в амниотической жидкости вблизи передней брюшной стенки плода. Грыжевые органы не имеют мембраны. Прогноз благоприятный: после оперативного лечения, проведенного в первые сутки жизни, выживают более 90% детей.
Исследование мочевыделительной системы
Почки: необходимо оценить их форму, размеры, локализацию, состояние паренхимы и ЧЛК.
Пиелоэктазия устанавливается по передне-заднему размеру лоханок, который в норме в сроки 20-24 недели не превышает 4 мм. Пиелоэктазия самостоятельно исчезает в течении данной беременности в 4,7 - 31% случаев. Умеренно выраженная пиелоэктазия имеет хороший прогноз: необходимость оперативного лечения после родов возникает редко. В большинстве случаев отмечается спонтанное разрешение пиелоэктазии после родов.
При инфантильном типе поликистоза (синдром Поттер I, „большие белые почки”) наблюдается двустороннее повышение эхогенности почек и увеличение их размеров.
Поликистозная дисплазия почек может быть односторонней и выглядит в виде увеличенной почки с множественными анэхогенными включениями. Двусторонняя поликистозная дисплазия почек, как и поликистозная болезнь почек, является фатальным состоянием. При их обнаружении показано прерывание беременности.
Мочевой пузырь: размеры не имеют принципиального значения, учитывая его способность к регулярному опорожнению. Исключение составляют выраженное его увеличение (мегацистик, синдром Prune-belly) или уменьшение (агенезия почек), остающиеся неизменными при динамическом наблюдении.
Оценка длины трубчатых костей
Для пренатальной диагностики скелетных дисплазий изучаются размеры, форма и эхогенность обеих бедренных и плечевых костей, костей голеней и предплечий. Укорочение длины трубчатых костей (в основном бедра и плеча) может являться маркером хромосомной аномалии: оно достаточно специфично для синдрома Дауна, где отмечается в 17,4-47,2% случаев.
Исследование плаценты и пуповины
Проводится оценка локализации плаценты, её толщины, структуры и степени зрелости по общепринятой методике.
Единственная артерия пуповины (ЕАП). В норме пуповина содержит 3 сосуда: одну вену и две артерии, в некоторых случаях — только два: вену и артерию. ЕАП сочетается с различными аномалиями развития в 20-67% случаев, с хромосомной патологией - в 5-20%. Самой вероятной цитогенетической находкой является трисомия по хромосоме 18 (синдром Эдвардса), но трисомия 21 (синдром Дауна) не характерна для ЕАП. Самой частой перинатальной патологией является задержка роста плода (8-50%), а риск гибели плода в родах достигает 20%. Частота: 1% у живорожденных (чаще у мальчиков). Диагностика: наиболее стабильные результаты можно получить после 18 недель беременности. Ведение: при сочетании с другими аномалиями развития показано пренатальное кариотипирование плода во II триместре беременности. При изолированной ЕАП кариотипирование считается целесообразным, так как ВПР, сочетающиеся с этой патологией и достоверно выявляемые пренатально, составляют 37%, трудно диагностируемые пренатально - 32%, и не диагностируемые пренатально - 31%.
Оценка количества амниотической жидкости (АЖ)
При подозрении на много- или маловодие необходимо пользоваться определением индекса амниотической жидкости (ИАЖ), который вычисляется, как сумма вертикальных карманов АЖ в четырёх (двух верхних и двух нижних) квадрантах живота беременной. В сроки 20-24 недели - в двух нижних квадрантах. ИАЖ выражается в сантиметрах с нормальными значениями 5-25 см.
Маловодие наиболее часто встречается при ВПР почек плода (агенезия), при плацентарной недостаточности и ВЗРП. Многоводие — при ВПР ЦНС (анэнцефалия, спино-мозговые грыжи), атрезии пищевода, иммунной и неиммунной водянках плода.
Верификация диагноза, т.е. патологоанатомическое исследование плодов, должна проводится во всех случаях пренатального обнаружения ВНЗ и прерывания беременности по медицинским показаниям, независимо от массы плода (включая массу менее 500,0).
Следует учитывать:
Некоторые эхографические находки требуют специальной подготовки материала к секции и применения определенных методик вскрытия (головной мозг плода). Структуры мозга одними из первых подвергаются аутолизу, поэтому при неправильной подготовке материала подтвердить или опровергнуть данные ультразвуковой диагностики невозможно;
Около 35% диагнозов, поставленных при УЗИ, доказать невозможно (вентрикуломегалия, пиелоэктазия, начальные формы неиммунной водянки плода);
В 5-10% патологоанатамических исследований выявляются ВПР, которые не подлежат ультразвуковой диагностике;
Наилучшие сроки для выявления ВПР в первом триместре - 10-14 недель, во втором - 20-24 недель, в третьем - 32-34 недели. Соблюдение этих правил уменьшает количество ненужных исследований, повышает качество ультразвуковых обследований.
Эхографические признаки хромосомных аномалий развития плода
1. Многие ВНЗ, в том числе и хромосомные, не сопровождаются грубыми изменениями и не имеют выраженной эхографической картины в пренатальном периоде.
2. Одной из задач УЗИ является раннее выявление эхографических маркеров (ЭГМ) ХА с целью формировании группы пациенток для пренатального кариотипирования плода.
3. Частота выявления ХА у плода зависит от количества найденных ультразвуковых признаков: при единственном эхографическом маркере частота ХА не превышает 8%, при наличии нескольких может составлять 53%, а при 8 и более она достигает 92%.
4. „Мягкие” признаки: гиперэхогенный кишечник, вентрикуломегалия, аномальная форма головки, гиперэхогенный фокус в сердце, кисты сосудистого сплетения, встречаются не только при ХА, но и при отсутствии каких-либо отклонений в развитии плода.
5. Исследование кариотипа плода позволяет составить рациональный план ведения беременности и решить вопрос о её продолжении.
Прервать беременность при обнаружении ХА у плода, несмотря на отсутствие грубых пороков развития, в связи с плохим прогнозом для жизни и здоровья;
Прервать беременность по медицинским показаниям в случае диагностики аномалий, не совместимых с жизнью;
При наличии пороков развития, совместимых с жизнью (омфалоцеле, атрезия 12-ти перстной кишки, диафрагмальная грыжа, расщелины лица) провести кариотипирование плода, так как нормальный кариотип означает хороший прогноз и является показанием к хирургической коррекции в полном объеме.
Эхографические маркеры ХА
Расширение воротникового пространства в сроки 10-14 недель.
1. Частота обнаружения этого маркера колеблется от 0,5 до 6,0%.
2. Наиболее частые хромосомные аномалии при расширении ВП: трисомии 13 (синдром Патау), 18 (синдром Эдвардса) и 21 (синдром Дауна), синдром Тернера. Из других аномалий и ВНЗ наиболее часто встречающихся при расширении ВП необходимо отметить синдромы Смита-Лемли-Опица, Меккеля-Грубера, Зельвегера, фето-фетальный трансфузионный синдром, аномалия развития стебля тела, гидролетальный синдром, спинальная мышечная атрофия.
3. Расширение воротникового пространства отмечается не только при ХА, но и в случаях врожденных пороков развития, диагностика которых возможна лишь в более поздние сроки беременности.
4. В норме ТВП в сроки 10-14 недель не должна превышать 3 мм.
5. Частота ХА и ВПР плода возрастает с увеличением ТВП:
При толщине до 3,4 мм ВПР плода выявляются у 2,4%, при 6,5мм — более чем у 35,6% плодов, при 7 мм и более неблагоприятные перинатальные исходы регистрируются в 64,3% — 100% случаев;
Частота выраженных ВПС составляет 17,3:1000 плодов, что в 2 раза выше, чем в популяции. Риск ВПС составляет 10% при ТВП 3мм и 75% при толщине более 4мм;
Диафрагмальная грыжа наблюдается в 7,5 раз чаще;
Частота омфалоцеле составляет 7:4000-4200, а в популяции 1: 3000;
В 40% случаев отмечается увеличение мочевого пузыря (мегацистик);
У беременных в возрасте старше 35 лет с расширением ВП риск хромосомных аномалий может достигать 90% при 5-9% ложноположительных результатов.
6. При расширении ВП показано пренатальное кариотипирование плода. Даже при нормальном кариотипе частота неблагоприятных перинатальных исходов составляет 32%, тогда как при нормальной толщине ВП - 7%.
Гиперэхогенный фокус (ГФ) в желудочках сердца плода:
Частота составляет в среднем 2,5 — 5,1%;
Виден как гиперэхогенное включение (одно или несколько) в одном (чаще в левом) или обоих желудочках;
В большинстве случаев (до 95%) ГФ исчезает до родов;
Можно расценивать как ЭГМ ХА только при сочетании с экстракардиальными аномалиями и/или факторами риска. При отсутствии других ЭГМ маркером ХА не является.
Частота выявления ХА у плода при различных эхографических изменениях
микроцефалия 30 — 66%
аномалии задней черепной ямки 33 — 44%
аномальные формы черепа 27 — 81%
патология лица 40 — 45%
кистозная гигрома шеи 68 -75%
врожденные пороки сердца 29 — 56%
дуоденальная атрезия 30 — 57%
гиперэхогенный кишечник 20 — 66%
аномалии кистей/стоп 37 — 42%
патология пуповины 40 — 44%
задержка развития плода 19 — 39%
Наиболее частые эхографические изменения у плодов с ХА
СИНДРОМ ДАУНА:
вентрикуломегалия 8,5 — 13,5%
патология шеи 2,6 — 50,9%
врожденные пороки сердца 7,2 — 56%
укорочение бедренной кости 33,3 — 47,5%
аномальное количество АЖ 25 — 60,9%
СИНДРОМ ЭДВАРДСА:
аномальные формы черепа 28,6 - 45 %
увеличение ТВП 39 — 82,1 %
кисты сосудистых сплетений 29,6 - 80 %
увеличение большой цистерны 32,1 — 92,3 %
врожденные пороки сердца 39 — 82,2 %
аномалии мочевыделительной системы 15 — 42,9 %
деформация кистей и пальцев рук 30 - 80 %
задержка развития плода 69 - 75 %
многоводие 32 — 53,8 %
Биохимические методы пренатальной диагностики
С самых ранних сроков беременности фето-плацентарный комплекс (ФПК) начинает вырабатывать специфические для беременности вещества, в основном белки, которые попадают в кровь матери. При наличии у плода пороков развития, хромосомных аберраций, содержание белков существенно изменяется, что позволяет использовать эти вещества в качестве маркеров различных патологических состояний плода. С развитием ультразвуковой диагностики значение биохимического скрининга для выявления ВПР плода существенно уменьшилось.
Альфафетопротеин (АФП)
Является белком, специфическим для плода. Его продукция начинается в синцитиотрофобласте и желточном мешке, а с 11-12 недель источником секреции становится печень плода. В АЖ АФП попадает через почки плода, в кровь матери - путём плацентарной диффузии (94%) или трансмембранозного транспорта из АЖ (6%).
1. В разных лабораториях, в связи с использованием разного оборудования и реактивов имеются существенные различия в количественных показателях содержания АФП в сыворотке крови матери. Поэтому с 1977 г. уровень содержания АФП рекомендовано измерять по унифицированной системе в единицах МоМ (multiples of median, или кратное среднему значению при нормальной беременности).
2. Концентрация АФП повышается как при открытых дефектах нервной трубки, так и при тератомах, кистозно-аденоматозном пороке развития легких, омфалоцеле, гастрошизисе, агенезии почек, обструктивных поражениях мочевыводящего тракта, атрезии 12-ти перстной кишки, диафрагмальной грыже и других пороках развития.
3. Повышение концентрации АФП при отсутствии ВПР указывает на повышенный риск осложнений беременности: недонашивания, преэклампсии, задержки роста или гибели плода, отслойки плаценты. Риск повышается с 19% при концентрации 2,5-2,9 МоМ до 67% при концентрации более 6 МоМ.
4. При нормальной беременности во II триместре концентрация АФП изменяется с увеличением срока: от 15 до 20 недель уровень АФП увеличивается линейно на 15% еженедельно, в среднем с 25 до 52 МЕ/мл. Оптимальным сроком для определения уровня АФП считается 15-22 недели.
5. На уровень АФП оказывают существенное влияние:
Масса тела матери (зависимость — обратная);
Количество плодов;
Некоторые соматические заболевания матери: при сахарном диабете значения АФП ниже нормы на 20%;
Расовая принадлежность: повышение на 10-15% у черной и жёлтой расы;
ВЗРП, маловодие;
Наличие ХА у плода: достоверное снижение уровня АФП у матерей с плодом, имеющим синдром Дауна (СД).
ПРИНЦИПИАЛЬНО ВАЖНО:
Определять собственные нормативы для каждого биохимического маркера в зависимости от срока беременности;
Определения маркеров в МоМ;
Медиана для здоровых плодов — 1 МоМ, для плодов с СД — 0,75 МоМ;
В каждом случае необходим расчет индивидуального риска;
Определение только АФП как метода скрининга не рентабельно, так как около 55 % беременных с его патологическими уровнями рожают здоровых новорожденных, но подвергаются дополнительным исследованиям (УЗИ, амниоцен¬тез).
Хорионический гонадотропин человека (ХГЧ)
Гликопротеин, который продуцируется синцитиотрофобластом и попадает в материнский кровоток вскоре после имплантации плодного яйца в стенку матки. В сыворотке крови матери обнаруживаются несколько фракций ХГЧ: биологически активная форма ХГЧ, неактивная форма, свободные и связанные a и b — фракции. В моче выявляется метаболит b-фракции.
При нормальной беременности с увеличением ее срока значения ХГЧ уменьшаются резко и нелинейно: с 30 до 18 МЕ/мл.
На синтез и секрецию ХГЧ во время беременности влияют многочисленные факторы: гонадотропин-релизинг гормон, эстрадиол, эпидермальный фактор роста, активин стимулируют выработку ХГЧ, а прогестерон подавляет его секрецию.
Имеются сообщения о значительном (двукратном и более) повышении уровня ХГЧ в сыворотке крови матери при трисомии 21 у плода.
Неконьюгированный эстриол (НЭ)
При нормальной беременности содержание НЭ в крови матери зависит от её срока и линейно возрастает в среднем с 0,6 до 2,0 нг/мл или на 20-25% еженедельно в интервале 15-22 недель.
Существенное отрицательное влияние на содержание НЭ в крови оказывает курение: уровень НЭ на 15% ниже нормы.
Возраст и масса тела беременной не влияют на уровень НЭ в крови.
Доказана тесная связь между уровнем НЭ в крови матери и СД у плода: медиана для плодов с СД составила 0,75 МоМ, что достоверно отличается от медианы здоровых плодов-1,0 МоМ.
Биохимический скрининг на синдром Дауна
Достоверное снижение АФП отмечено в 20% беременностей с СД при 5% ложноположительных результатов.
Существенное повышение уровня ХГЧ, в два и более раз, регистрируется в 35-40% случаев СД.
Чувствительность теста на СД с использованием НЭ составила 35%.
В практической медицине для скрининга на СД рекомендуется использовать сочетание АФП и ХГЧ (двойной тест): чувствительность двойного теста с учетом возраста матери варьирует в пределах 56-70% при 5% ложноположительных результатов.
При комбинации АФП, ХГЧ и НЭ (тройной тест) с учётом возраста матери чувствительность теста в отношении СД повышается до 60 — 70% при 5% ложноположительных результатов.
Новые биохимические маркеры СД
РАРР-А (плазменный протеин А, связанный с беременностью) — это гликопротеин большой молекулярной массы. Вырабатывается синцитиотрофобластом и появляется в крови матери с 5 недель беременности. С увеличением срока беременности концентрация РАРР-А в норме постоянно повышается. При различных патологических состояниях (неразвивающаяся беременность, патология хромосом, в том числе СД) содержание РАРР-А в крови матери существенно уменьшается. Наибольшие изменения уровней этого маркера как в норме, так и при патологии плода отмечены в I триместре беременности.
SP 1 - специфический для беременности гликопротеин, который продуцируется синцитиотрофобластом и его производными. В крови матери регистрируется уже с 7-го дня после овуляции. При физиологической беременности до 35 недель его концентрация растет, а затем остается постоянной. При СД в I триместре отмечается снижение концентрации SP1 в крови матери, а во II триместре его уровень превышает нормативные значения. Разница в медианах для здоровых плодов и плодов с СД невелика: 1,0 и 1,28 МоМ, что ограничивает его использование для скрининга на СД.
Ингибин А - гликопротеин, характеризующийся способностью подавлять секрецию фолликулостимулирующего гормона. Уровень ингибина А при нормальной беременности с ростом срока беременности понижается, а при наличии СД повышается. Медиана ингибина А для плодов с СД в I триместре составляет 1,41 МоМ, во II триместре — 1,85 МоМ.
SOD (дисмутазы супероксид) относится к семейству металлопротеинов. Ген SOD расположен в длинном плече 21-й хромосомы. Установлено, что активность SOD в материнской сыворотке при СД выше, чем в контрольной группе (3,12+0,73 и 2,2 +0,7 мл). Метод определения SOD не используется в качестве единственного теста на СД ввиду своей низкой чувствительности.
Гипергликозилат ХГЧ - одна из фракций ХГЧ, на долю, которой приходится около 3% от всех молекул ХГЧ. Он является продуктом клеток цитотрофобласта и может определяться в крови и моче беременных. Определение гипергликозилата в крови матери позволяет выявить 60% плодов с СД, что сравнимо с эффективностью стандартного тройного теста.
Протеин S100 - это белок с низкой молекулярной массой, который присутствует во многих тканях организма. Генетический код этого белка зарегистрирован в длинном плече 21-й хромосомы в области 22.2-22.3, которая отвечает за фенотипические проявления СД. При СД концентрация S100 в крови плода резко возрастает. Однако S100 не проходит плацентарный барьер, что не позволяет его использовать в качестве маркера СД.
Следует отметить:
Эффективность раннего биохимического скрининга по 4 маркерам (АФП, ХГЧ, НЭ, РАРР-А) без УЗИ ниже, чем ультразвукового скрининга по ТВП в ранние сроки беременности: 70,1 и 72,7% соответственно.
Наибольшую чувствительность (88,3%) имеет метод, сочетающий скрининг по ТВП с тремя биохимическими маркерами: свободный b- ХГЧ, НЭ, РАРР-А.
Лучшим по соотношению цена/качество является сочетание оценки ТВП с определением РАРР-А (чувствительность 81,2%) или ТВП с определением РАРР-А и свободного b-ХГЧ (чувствительность 86,4%).
Синдромы Эдвардса и Патау — наиболее распространенные трисомии после синдрома Дауна:
В I триместре беременности характерно снижение уровня свободного b-ХГЧ, РАРР-А и ингибина А. При этом концентрация РАРР-А снижается в большей степени, чем b-ХГЧ и эстриола.
В I триместре беременности определением уровней b-ХГЧ и РАРР-А в сочетании с оценкой ТВП можно выявить 84-90% случаев трисомии 13 (Патау) при 0,1-0,5% ложноположительных результатов, и от 58 до 89% трисомии 18 (Эдвардса).
При трисомии 18 снижаются все показатели “тройного” теста: АФП - 0,6 МоМ, НЭ - 0,5 МоМ, ХГЧ - 0,3 МоМ. Точность теста составляет 80%, при 0,5% ложно-положительных результатов.
При синдроме Тернера в ранние сроки беременности уровень b-ХГЧ не изменяется, а концентрация РАРР-А и ингибина А снижается. Для синдрома Тернера чувствительность теста в сочетании с оценкой ТВП составляет около 90%.
Общий вывод: эффективность пренатального обследования для выявления ХА значительно возрастает при совокупной оценке биохимичских маркеров с данными УЗИ, наиболее чувствительным из которых является измерение толщины воротникового пространства в сроки 10-14 недель.
Пренатальная диагностика генных болезней
Общие замечания:
На долю генных нарушений приходится в общей сложности до 5% всей врожденной патологии.
Более половины случаев моногенной патологии, требующей пренатальной диагностики, составляют такие сравнительно частые и тяжелые болезни, как муковисцидоз, миодистрофия Дюшена, синдром ломкой X-хромосомы, гемофилия А, фенилкетонурия, поликистоз легких, атаксия Фридрейха, синдром Верднига-Гоффмана и синдром Шарко-Мари-Тус.
Молекулярная (ДНК) диагностика проводится на уровне отдельных генов, и даже на уровне фрагментов ДНК самих генов или близлежащих ДНК-последовательностей.
Преимущества молекулярной диагностики:
Универсальность, возможность использовать для анализа любые ДНК-содержащие клетки организма;
Возможность проведения анализа на любой стадии онтогенеза, начиная со стадии зиготы;
Оптимальный срок для пренатальной диагностики молекулярными методами — I триместр беременности, что требует детального ДНК-анализа семьи еще до её наступления.
Материал для анализа
Обследование семей высокого риска и больных в случае генных болезней: муковисцидоз, фенилкетонурия, проводят с использованием пятен крови, нанесенных на фильтрованную бумагу, что значительно облегчает транспортировку и хранение образцов из удаленных от диагностических центров районов;
Для некоторых других генных болезней: гемофилия А, миодистрофия Дюшена, диагностика проводится на чистых препаратах ДНК, выделенных из крови плода, клетки которого получают при помощи стандартных инвазивных методов.
Основа ДНК-диагностики — полимеразная цепная реакция синтеза ДНК (ПЦР). Метод позволяет избирательно умножать число (аплифицировать) относительно небольших участков ДНК, длиной от нескольких десятков до нескольких тысяч пар нуклеотидов, используя в качестве матрицы любые образцы ДНК, содержащие необходимую последовательность пар нуклеотидов.
Прямая диагностика основана на непосредственной идентификации мутаций в определенном гене. Достоверность молекулярной диагностики прямым методом очень высока и приближается к абсолютной.
Косвенная (непрямая) диагностика основана на маркировке мутантного гена (больной хромосомы) с помощью молекулярных маркеров. Частота ошибочного диагноза может достигать 2%.
Сочетание ДНК-диагностики с другими методиками:
В случае гемофилии А возможно прямое определение уровня фактора VIII свертывания крови в пуповинной крови плода после 20 недель беременности;
При адреногенитальном синдроме — прямое исследование содержания 17-ОН прогестерона в амниотической жидкости;
Диагностика ломкой Х-хромосомы дополняется анализом культуры лимфоцитов пуповинной крови плода;
В случае муковисцидоза дополнительная информация о состоянии плода может быть получена при биохимическом исследовании активности ферментов АЖ в 17-19 недель беременности.
Инвазивные методы исследования в пренатальной диагностике
Инвазивные диагностические методы (ИДМ): аспирация ворсин хориона (биопсия хориона), пункция плаценты, пуповины или амниотической полости с целью получения биологического материала для дальнейших исследований (цитогенетических, молекулярных, биохимических). Наиболее часто применяются трансабдоминальная аспирация ворсин хориона, амниоцентез и кордоцентез, которые позволяют достичь наибольшей эффективности при относительно малых экономических затратах. Лечебные инвазивные методы: операции с целью пренатальной коррекции некоторых пороков развития плода, а также вмешательства, направленные на лечение некоторых заболеваний плода (анемии).
Запомните:
1. Все инвазивные вмешательства проводятся под ультразвуковым контролем
2. Любое внутриматочное вмешательство сопряжено с риском прерывания беременности:
Необходимо тщательно оценить риск рождения ребенка с ВНЗ и риск потери беременности после ИДМ;
В течение 10-14 дней после обследования с применением ИДМ прерывается в среднем 2,5% беременностей: частота осложнений зависит от вида вмешательства, срока беременности, опыта врача;
Наименьший риск отмечается при амниоцентезе: 0,2-2,0%, наибольший — при кордоцентезе: до 5,4% ;
Показатели перинатальных потерь при ИДМ не превышают показатели потери плодов среди всех беременных популяции.
Показания (после консультации врача-генетика):
Возраст беременной более 35 лет;
Отягощенный анамнез: рождение ребенка с ХА или моногенной патологией;
Наличие семейной хромосомной транслокации или идентифицированной генной мутации;
Мать с наличием любой наследственной болезни, связанной с X-хромосомой;
Любой родитель с наличием наследственного нарушения обмена веществ;
Беременность после трех или более самопроизвольных абортов;
Изменения, выявленные при беременности: эхографические и биохимические маркеры ХА.
Амниоцентез:
РАННИЙ АМНИОЦЕНТЕЗ ПРОВОДИТСЯ В СРОКИ 9-14 НЕДЕЛЬ
Сопровождается более высоким риском самопроизвольного аборта в сравнении с абдоминальной биопсией хориона;
Малоэффективен для пренатальной диагностики, т.к. в АЖ содержится мало клеток пригодных для культивирования, которое требует более 40 дней. При этом успешный результат может быть получен не более чем в 40% случаев.
АМНИОЦЕНТЕЗ В СРОКИ 14-18 НЕДЕЛЬ (ГЕНЕТИЧЕСКИЙ АМНИОЦЕНТЕЗ):
Риск самопроизвольного аборта составляет не более 0,5-0,7%;
Возможны ошибки вследствие клеточного мозаицизма: около 2,5% клеточных культур АЖ дают вторую клеточную культуру;
Измерение в АЖ содержания АФП и ацетилхолинэстеразы (при АФП более 2 МоМ) повышает точность диагностики дефектов нервной трубки плода до 97% при 0,5% ложно-положительных результатов.
Аспирация ворсин хориона:
Образцы ворсин хориона содержат материал трофобласта с полным хромосомным набором плода;
Кариотип плода может быть определен непосредственно из ворсин хориона прямым методом, что является наиболее быстрым и экономически выгодным;
Возможно и культивирование клеток, чаще всего вместе с прямым анализом.
ПОКАЗАНИЯ К АСПИРАЦИИ ВОРСИН ХОРИОНА:
Рождение в семье ребенка с хромосомными заболеваниями;
Транслокации и инверсии хромосом у одного из супругов;
Заболевания, сцепленные с полом;
Некоторые моногенные заболевания;
Ультразвуковые маркеры хромосомных аберраций.
ПРОТИВОПОКАЗАНИЯ:
Воспалительные заболевания с повышением температуры тела;
Кровянистые выделения из половых путей;
Предшествующие лапаротомии и операции на матке и шейке матки;
Множественные узлы миомы матки;
III-IV степень чистоты влагалища.
Оптимальный срок процедуры — 9-11 недель.
МЕТОДИКА:
Доступ трансцервикальный или трансабдоминальный. Трансцервикальной манипуляции может препятствовать генитальный герпес, рубцы на шейке матки, полипы, гиперретрофлексия матки. Чаще применяют трансабдоминальную аспирацию.
УЗИ проводится до и во время процедуры.
Специальная игла 20G с мандреном.
Требуется не более 10-20 мг материала, что составляет менее 1% функциональной ткани хориона.
Процедура производится амбулаторно с последующим наблюдением за пациенткой в дневном стационаре в течение 2-х часов.
ПОЛУЧЕННЫЙ МАТЕРИАЛ.
Ворсина хориона состоит из: внешнего слоя — гормонально активного синцитиотрофобласта, среднего слоя - цитотрофобласта, внутреннего слоя — мезодермального. Цитотрофобласт имеет высокий митотический индекс со многими спонтанными митозами, пригодными для немедленного хромосомного анализа. Хромосомные препараты пригодные для анализа удается получить от 95 до 98%.
ОСЛОЖНЕНИЯ:
Кровомазание или кровотечение: в 1-4% при трансабдоминальном доступе и 20% при трансцервикальном;
Ретрохориальная гематома;
Разрыв плодных оболочек в 0,3-0,5% случаев;
Частота самопроизвольных абортов по отечественным данным составляет в среднем 3,3%: при трансцервикальном доступе — 4,8%, при трансабдоминальном — 2,2%;
Частота самопроизвольных абортов по зарубежным данным составляет 0,6-0,8%;
Внутриматочные инфекции: 0,2% — 0,5%;
Плодово-материнская трансфузия.
НЕДОСТАТКИ МЕТОДА:
Возможность загрязнения взятого образца материнской децидуальной тканью;
Наличие в полученном материале мозаицизма и псевдомозаицизма: 1% и 0,4% соответственно.
Плацентоцентез - аспирация ткани плаценты.
ПОКАЗАНИЯ
Те же, что и для биопсии хориона.
МЕТОДИКА
Осуществляется во II триместре под контролем УЗИ с использованием иглы 18-20 G с мандреном. Масса аспирата должна составлять не менее 20-50 мг.
ПРЕИМУЩЕСТВА
Перед биопсией хориона:
Исключается негативное влияние на морфо- и органогенез плода;
Место взятия аспирата расположено значительно дальше от децидуальной оболочки, чем при аспирации хориона, поэтому реже наблюдается загрязнение образцов материнскими клетками;
Во II триместре возможен тщательный УЗ-контроль за состоянием плода, что, в некоторых случаях, позволяет отказаться от манипуляции при наличии противопоказаний и снизить количество осложнений;
Можно использовать при маловодии;
Прямой метод получения хромосомных препаратов из ткани плаценты значительно быстрее других, и результат может быть известен в день забора материала, что позволяет принять быстрое решение при выявлении аномалий развития плода во время УЗИ;
Успешный забор материала с последующим цитогенитическим или ДНК-анализом составляет 99%.
ОСЛОЖНЕНИЯ
Те же, что при аспирации ворсин хориона. Частота самопроизвольных абортов при плацентоцентезе несколько ниже: 0,9-2,2%.
КОРДОЦЕНТЕЗ
Взятие крови из сосудов пуповины.
ВОЗМОЖНОСТИ
Пренатальное кариотипирование, диагностика моногенных заболеваний, внутриутробного инфицирования, исследование кислотно-основного состояния, гематологических и биохимических показателей плода.
ПРЕИМУЩЕСТВА
Кровь в сравнении с другим биологическим материалом дает значительно больше информации о состоянии и развитии плода;
При пренатальном кариотипировании получения цитогенетического ответа возможно уже через 48-72 часа, так как лимфоциты крови плода обладают способностью к быстрому делению;
Выявление всех особенностей строения хромосом, так как при высокой митотической активности лимфоцитов имеется возможность изучения большого количества метафазных пластинок и применения различных методов дифференцированного окрашивания хромосом, что не всегда доступно при изучении препаратов хориона;
В отличие от крови плода, истинной плодной ткани, клетки хориона и амниона являются производными внезародышевой эктодермы и, в некоторых случаях, имеют набор хромосом, отличный от клеток плода.
ПОКАЗАНИЯ
Диагностический кордоцентез
1. Быстрое кариотипирование:
Пороки развития плода;
Эхографические маркеры хромосомных аберраций;
Мозаицизм, выявленный при исследовании вод/плаценты;
Безрезультатность предыдущего цитогенетического анализа.
2. Традиционные показания:
Возраст беременной более 35лет;
Рождение в анамнезе ребенка с хромосомной патологией;
Хромосомная транслокация у одного из супругов;
Возможность ХА по данным сывороточных маркеров крови матери.
3. Диагностика моногенных заболеваний плода:
Метаболические нарушения;
Ферментопатии;
Врожденные заболевания крови.
4. Диагностика внутриутробных инфекций:
Токсоплазмоз;
Цитомегаловирус;
Краснуха;
Парвовирус В19;
Ветрянка (варицелла).
5. 5. Аллоиммунизация и аутоиммунизация:
Резус-конфликт;
Идиопатическая тромбоцитопеническая пурпура.
6. 6. Изучение внутриутробного состояния плода:
Кислотно-основное состояние крови плода
Лечебный кордоцентез
Внутриутробные переливания препаратов крови при анемии
Внутриутробное введение лекарств
ПРОТИВОПОКАЗАНИЯ:
Абсолютные:
Не существует.
Относительные:
Угроза прерывания беременности;
Острые воспалительные процессы любой локализации;
Ожирение;
Многоводие и маловодие;
Множественная миома матки.
Оптимальный срок
Вторая половина II триместра беременности: в среднем в 24 (20-29) недели, что обусловлено диаметром сосудов пуповины, который в эти сроки достигает оптимальных для кордоцентеза размеров.
Методика:
Пункция пуповины проводится спинальной иглой (с мандреном) длиной от 9 до 16 см диаметром от 20 до 25G под контролем ультразвука. Возможно применение специальных игл покрытых составом, улучшающим визуализацию иглы на экране.
Предпочительно пунктировать свободную петлю пуповины по методике „свободная рука”. Возможна пункция корня пуповины, однако в этом случае легко получить смешанную кровь.
При цитогенетических исследованиях кровь забирают в шприц, промытый гепарином. Материал для ДНК-диагностики требует раствора EDTA. Для вирусологических анализов нужна сыворотка крови, поэтому добавления специальных растворов не требуется.
Проведение пренатального обследования требует от 1 до 4 мл крови в зависимости от вида дальнейших исследований, что составляет от 4 до 16% общего фетоплацентарного объема крови в начале II триместра беременности.
В большинстве случаев процедура длится не более 5-7 минут.
С первой попытки кровь получают в 63-87% случаев, в опытных руках частота успеха с первой попытки достигает 92-97%.
Осложнения:
1. Транзиторная брадикардия - урежение сердцебиения до 100 ударов и менее в минуту.
Наблюдается от 1,5 до 13,2%;
Чаще возникает у плодов с ВЗРП, анемией, неиммунной водянкой;
Как правило, длится немногим более минуты и восстанавливается самостоятельно, без каких либо медикаментозных вмешательств.
2. Кровотечение из места пункции.
Отмечается в среднем в 31,3 (29-62)%;
Частота возрастает при увеличении продолжительности процедуры;
В 78-86%случаев кровотечение продолжается менее минуты, бывает необильным и самостоятельно прекращается;
Минимально регистрируемый объем кровопотери составляет 0,25 мл, максимальный - до 15 мл;
У беременных с резус-отрицательной кровью требуется профилактика изосенсибилизации путем введения анти-D-иммуноглобулина.
3. Гематомы пуповины.
Частота не превышает 0,5%;
Имеют небольшие размеры и не влияют на перинатальные исходы.
4. Воспалительные осложнения (хориоамнионит).
Частота составляет 0,6-2,9% непосредственно после процедуры;
В 28-40% случаев прерывания беременности, связанного с кордоцентезом, впоследствии выявляются воспалительные изменения в плодном яйце;
В течение нескольких дней после инвазивного вмешательства возможно проведение профилактической антибактериальной терапии.
5. Прерывание беременности.
Наступает чаще в течение 10-14 дней после процедуры;
Частота прерывания, непосредственно связанного с кордоцентезом, составляет 2%-2,5%, прерывания, наступившего через 2 недели после процедуры, — до 1,5%;
Перинатальные потери составляют не более 2-2,5%;
Наиболее высокие перинатальные потери регистрируются у плодов с аномалиями развития (13,1%) и с задержкой развития (8,9%);
В 23% случаев причиной прерывания беременности являются хориоамниониты, в 15% — тяжелая форма плацентарной недостаточности и задержка развития плода, в 30% — повышенная сократительная активность матки, в 32% — непосредственную причину установить не удается;
Частота перинатальных потерь повышается с увеличением числа попыток проведения кордоцентеза.
Тактика ведения пациенток с риском рождения детей с ХА:
«Пассивная»
ИДМ проводится всем беременным, имеющим факторы риска, что дает относительно невысокую частоту выявления ХА, поскольку среди пациенток выделяется максимально большая группа риска.
При наличии аппаратуры для УЗИ с невысокой разрешающей способностью, не позволяющей проводить качественные эхографические исследования;
При среднем уровне подготовки специалистов ультразвуковой диагностики;
При отсутствии возможности УЗИ в динамике.
«Активная»
Формирование более узкой группы риска, что позволяет повысить выявляемость ХА и уменьшить как количество инвазивных вмешательств, так и число потерь беременностей, связанных с ИДМ.
При наличии аппаратуры для УЗИ среднего и экспертного класса;
При высокой квалификации специалистов УЗ-диагностики, позволяющей достоверно оценивать наличие маркеров хромосомной патологии у плода;
При возможности УЗИ в динамике во время беременности и оказания необходимой помощи новорожденным в полном объеме.
Приложения
Нормальные параметры фетометрии плода по г. Ярославлю
|
Бипариетальный размер (см) |
Окружность живота (см) |
Длина бедра (см) |
||||||||
|
Процентили |
||||||||||
|
Срок (нед) |
||||||||||
Нормальные показатели массы плода по г. Ярославлю
|
Срок беременности (нед) |
Масса плода (г) |
||
|
Процентили |
|||
Пределы допустимых значений АФП и ХГЧ для беременных
(по данным Федерального центра пренатальной диагностики г. Санкт-Петербург)
НОРМЫ ПО СОДЕРЖАНИЮ АФП В СЫВОРОТКЕ КРОВИ
|
Медиана, |
Толерантные |
Медиана, МЕ/мл |
Толерантные пределы, МЕ/мл |
|
НОРМЫ ПО СОДЕРЖАНИЮ ХГЧ В СЫВОРОТКЕ КРОВИ
|
Срок беременности (нед. после зачатия) |
Медиана, мМЕ/мл |
Толерантные пределы, мМЕ/мл |
|
|
Без разведения |
|||
Внимание! Мом высчитывается по отношению уровня АФП и ХГЧ в МЕ/мл к медиане в МЕ/мл. Нормальные значения Мом при физиологической беременности - 0,5-2Мом.
Алгоритм показаний к пренатальному кариотипированию
Условные сокращения:
- ФР - фактор риска
- ЭГМ ХА - эхографические маркеры хромосомных аномалий
- АКВ - аномальное количество вод (мало-и многоводие)
- ПК - пренатальное кариотипирование