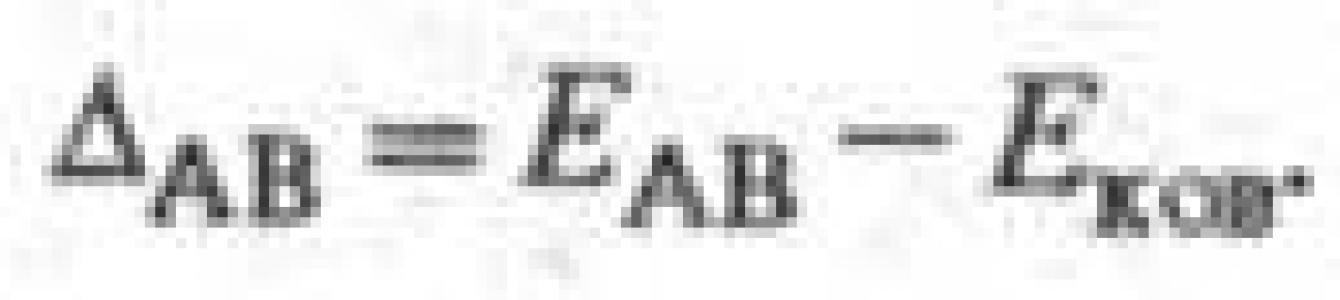Ионизация - процесс отделения электронов от нейтрального атома или молекулы - возможна при затрате энергии на преодоление притяжения между вырываемым электроном и остальной частью атома. Эту энергию называют работой ионизации А. Если ионы образуются после столкновения быстрого электрона с атомом, то такая ионизация называется ударной.
Наименьшее значение кинетической энергии электронов, при которой происходит ионизация, чуть больше работы ионизации А i:А i = (mv 2 /2)/(1+m/M).
Отношение масс электрона и атома всегда малая величина, например для атома водорода m/M=5,443x10 -4 , и величина, стоящая в скобках, близка к единице. Разность потенциалов, при прохождении которой электрон или другая частица с таким же зарядом приобретает кинетическую энергию, равную работе ионизации, называют потенциалом ионизации: V i:V i =А i /e.
Наиболее точный способ определения потенциала ионизации состоит в измерении энергий переходов атомов при изучении их линейчатых спектров. Наиболее наглядный способ - это измерение потенциала между катодом К и сеткой С газоразрядной трубки JI (см. рис.). Если давление в трубке невелико, то электроны, испущенные накаленным катодом, в промежутке К - С не сталкиваются с молекулами газа. При этих условиях энергия электронов, прошедших сквозь сетку, будет равна V e . Такие электроны не смогут достигнуть коллектора K 2 , поскольку его потенциал меньше V e на величину ∆V В результате ток в гальванометре Г будет равен нулю. При увеличении V до значений V > V min в цепи гальванометра появится ток: в объеме С - K 2 образуются положительные ионы, которые притягиваются сборником K 2
Ионизация электронным ударом - один из многих способов получения ионов. В газе, нагретом до высокой температуры, например в солнечной короне, атомы ионизируются, сталкиваясь между собой. Много ионов и в обычном пламени. Так, горящая свеча разряжает электроскоп.
Кванты электромагнитного излучения выбивают из атомов электроны, если обладают достаточной энергией. Такой процесс называют фотоионизацией. Рентгеновские лучи, γ-кванты (см. Гамма-излучение) оставляют в газах следы из ионизированных атомов.
В газе, нагретом до высокой температуры, атомы движутся с большой скоростью и, сталкиваясь друг с другом, теряют электроны. Этот вид ионизации газа - термическая ионизация. Если температура вещества достигает многих миллиардов градусов, атомы теряют все электроны, и образуется смесь атомных ядер и электронов - высокотемпературная плазма. Атомы, потерявшие несколько электронов, называют многозарядными ионами. В солнечном излучении было открыто несколько спектров, не совпадающих ни с одним спектром нового элемента. Казалось, что обнаружена целая группа еще не открытых элементов. Однако вскоре выяснилось, что необычные спектры принадлежат многозарядным ионам обычных элементов и только гелий - новый элемент, впервые обнаруженный на Солнце по его спектру.
Важным энергетическим параметром для изучения химических процессов является энергия ионизации атома. Применительно к атому водорода это энергия, которую необходимо затратить, для того чтобы оторвать электрон от протона.
Она равна сумме потенциальной энергии системы и кинетической энергии электрона.
E a = E+T= -Z . e/2 . R, (2.7)
где E a -энергия атома водорода.
Из формулы (2.7) следует, что уменьшение расстояния между электроном и ядром и увеличение заряда ядра означают увеличение силы притяжения электрона к ядру. То есть, потребуется больше энергии для отрыва электрона от ядра. Чем больше энергии требуется для разрыва этой связи, тем более стабильна система.
Следовательно, если разрушение связи (отделение электрона от ядра) в одной системе требует больше энергии, чем в другой, то первая система более стабильна.
Энергия ионизации атома - та энергия, что требуется для разрыва связей в атоме водорода, была определена экспериментально . Она равна 13,6 эВ (электронвольт). Также экспериментально была определена энергия, необходимая для отрыва электрона от ядра в атоме, состоящем из одного электрона и ядра, заряд которого в два раза больше, заряда ядра атома водорода. В этом случае необходимо затратить в четыре раза больше энергии (54,4 эВ).
Как известно из электростатики, энергия (Т ), необходимая для разрыва связи между противоположенными зарядами (Z и е ), находящимися друг от друга на расстоянии R , определяется равенством
Она пропорциональна величине зарядов и обратно пропорциональна расстоянию между ними. Такая корреляция вполне понятна: чем больше заряды, тем сильнее их притяжение друг к другу, следовательно, больше энергии требуется для разрыва связи между ними. И чем меньше расстояние между ними, тем больше энергии придется затратить на разрушение связи. Благодаря этому становится понятным, почему атомная система, где заряд ядра в два раза больше, чем заряд ядра в атоме водорода, более стабильна и требует больше энергии для отрыва электрона.
СРОДСТВО К ЭЛЕКТРОНУ частицы (молекулы, атома, иона), миним. энергия А, необходимая для удаления электрона из соответствующего отрицат. иона на бесконечность. Для частицы X С. к э. относится к процессу:
С. к э. равно энергии ионизации E отрицат. иона X - (первому потенциалу ионизации U 1 , измеряется в эВ). По аналогии с потенциалом ионизации различают первое и второе С. к э., а также вертикальное и адиабатическое С. к э. многоатомной частицы. Термрдинамич. определение С. к э.-стандартная энтальпия р-ции (1) при абс. нуле температуры:
АN А (N А ~постоянная Авогадро).
Надежных эксперим. данных по С. к э. атомов и молекул до сер. 60-х гг. 20 в. практически не существовало. В настоящее время использование равновесных методов получения и исследования отрицат. ионов позволило получить первые С. к э. для большинства элементов периодич. системы и неск. сотен орг. и неорг. молекул. Наиб. перспективные методы определения С. к э.-фотоэлектронная спектроскопия (точность + 0,01 эВ) и масс-спектрометрич. исследование равновесий ионно-молекулярных реакций. Квантовомех. расчеты С. к э. аналогичны расчетам потенциалов ионизации. Наилучшая точность для многоатомных молекул составляет 0,05-0,1 эВ.
Наибольшим С. к э. обладают атомы галогенов. Для ряда элементов С. к э. близко к нулю или меньше нуля. Последнее означает, что для данного элемента устойчивого отрицат. иона не существует. В табл. 1 приведены значения С. к э. атомов, полученные методом фотоэлектронной спектроскопии (работы У. Лайнебергера с сотрудниками).
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ
, величина, характеризующая способность атома к поляризации ковалентных связей. Если в двухатомной молекуле А - В образующие связь электроны притягиваются к атому В сильнее, чем к атому А, то атом В считается более электроотрицательным, чем А.
Л. Полинг предложил (1932) для количеств. характеристики электроотрицательности использовать термохим. данные об энергии связей А-А, В - В и А - В - соотв. Е АА, Е вв и Е АВ. Энергия гипотетической чисто ковалентной связи А - В (Е ков) принимается равной среднеарифметич. или среднегеометрич. значению величин E AA и Е ВВ. Если электроотрицательности атомов А и В различны, то связь А - В перестает быть чисто ковалентной и энергия связи Е АВ станет больше Е ков на величину
![]()
Чем больше различие электроотрицательностей атомов А и В, тем больше величина Используя эмпирич. ф-лу ![]() (множитель 0,208 возникает при переводе значений энергии из ккал/моль в эВ) и принимая для атома водорода произвольное значение электроотрицательности равное 2,1, Полинг получил удобную шкалу относит. числовых значений электроотрицательности, часть к-рых приведена в табл. Наиб. электроотрицателен самый легкий из галогенов - F, наименее - тяжелые щелочные металлы.
(множитель 0,208 возникает при переводе значений энергии из ккал/моль в эВ) и принимая для атома водорода произвольное значение электроотрицательности равное 2,1, Полинг получил удобную шкалу относит. числовых значений электроотрицательности, часть к-рых приведена в табл. Наиб. электроотрицателен самый легкий из галогенов - F, наименее - тяжелые щелочные металлы.
Для количеств. описания электроотрицательности, помимо термохим. данных, используют также данные о геометрии молекул (напр., метод Сандерсона), спектральные характеристики (напр., метод Горди).
АТОМНЫЕ РАДИУСЫ , эффективные характеристики атомов, позволяющие приближенно оценивать межатомное (межъядерное) расстояние в молекулах и кристаллах. Согласно представлениям квантовой механики, атомы не имеют четких границ, однако вероятность найти электрон, связанный с данным ядром, на определенном расстоянии от этого ядра быстро убывает с увеличением расстояния. Поэтому атому приписывают нек-рый радиус, полагая, что в сфере этого радиуса заключена подавляющая часть электронной плотности (90-98%). Атомные радиусы - величины очень малые, порядка 0,1 нм, однако даже небольшие различия в их размерах могут сказываться на структуре построенных из них кристаллов, равновесной конфигурации молекул и т.п. Опытные данные показывают, что во мн. случаях кратчайшее расстояние между двумя атомами действительно примерно равно сумме соответствующих атомных радиусов (т. наз. принцип аддитивности атомных радиусов). В зависимости от типа связи между атомами различают металлич., ионные, ковалентные и ван-дер-ваальсовы атомные радиусы.
Металлич. радиус равен половине кратчайшего расстояния между атомами в кристаллич. структуре металла. Его значение зависит от координац. числа К (числа ближайших соседей атома в структуре). Чаще всего встречаются структуры металлов с К = 12. Если принять значение атомных радиусов в таких кристаллах за 1, то атомные радиусы металлов с К, равными 8, 6 и 4, составят соотв. 0,98, 0,96 и 0,88. Близость значений атомных радиусов разл. металлов - необходимое (хотя и недостаточное) условие того, что эти металлы образуют твердые р-ры замещения. Так, жидкие К и Li (радиусы 0,236 и 0,155 нм соотв.) обычно не смешиваются, а К с Rb и Cs образуют непрерывный ряд твердых р-ров (радиусы Rb и Cs-соотв. 0,248 и 0,268 нм). Аддитивность металлич. атомных радиусов позволяет с умеренной точностью предсказывать параметры кристаллич. решеток интерметаллич. соединений.
Ионные радиусы используют для приближенных оценок кратчайших межъядерных расстояний в ионных кристаллах, предполагая, что эти расстояния равны сумме соответствующих ионных радиусов атомов. Существует неск. систем значений ионных радиусов, отличающихся для индивидуальных ионов, но приводящих к примерно одинаковым межъядерным расстояниям в ионных кристаллах. Впервые ионные радиусы были определены в 20-х гг. 20 в. В. М. Гольдшмидтом, опиравшимся на рефрактометрич. значения радиусов F - и О 2- , равных соотв. 0,133 и 0,132 нм. В системе Л. Полинга за основу принято значение радиуса иона О 2- , равное 0,140 нм, в распространенной системе Н. В. Белова и Г. Б. Бокия радиус этого же иона принят равным 0,136 нм, в системе К. Шеннона -0,121 нм (К = 2).
Ковалентный радиус равен половине длины одинарной хим. связи X-X, где Х - атом неметалла. Для галогенов ковалентный атомный радиус - это половина межъядерного расстояния в молекуле Х 2 , для S и Se- в Х 8 , для С-в кристалле алмаза. Ковалентные радиусы F, Cl, Br, I, S, Se и С равны соотв. 0,064, 0,099, 0,114, 0,133, 0,104, 0,117 и 0,077 нм. Ковалентный радиус водорода принимают равным 0,030 нм, хотя половина длины связи Н-Н в молекуле Н 2 равна 0,037 нм. Пользуясь правилом аддитивности атомных радиусов, предсказывают длины связей в многоатомных молекулах. Напр., длины связей С-Н, С-F и С-С1 должны составлять 0,107, 0,141 и 0,176 нм соотв., и они действительно примерно равны указанным значениям во мн. орг. молекулах, не содержащих кратных углерод-углеродных связей; в противном случае соответствующие межъядерные расстояния уменьшаются.
Ван-дер-ваальсовы радиусы определяют эффективные размеры атомов благородных газов. Считают также, что эти радиусы равны половине межъядерного расстояния между ближайшими одинаковыми атомами, не связанными между собой хим. связью, т.е. принадлежащими разным молекулам, напр. в молекулярных кристаллах. Значения ван-дер-ваальсовых радиусов находят, пользуясь принципом аддитивности атомных радиусов, из кратчайших контактов соседних молекул в кристаллах. В среднем они на ~ 0,08 нм больше ковалентных радиусов. Знание ван-дер-ваальсовых радиусов позволяет определять конформацию молекул и их упаковку в молекулярных кристаллах. Энергетически выгодными обычно бывают такие конформации молекул, в к-рых перекрывание ван-дер-ваалъсовых радиусов валентно не связанных атомов невелико. Ван-дер-ваальсовы сферы валентно связанных атомов в пределах одной молекулы перекрываются. Внеш. контур перекрывающихся сфер определяет форму молекулы. Молекулярные кристаллы подчиняются принципу плотной упаковки, согласно к-рому молекулы, моделируемые своим "ван-дер-ваальсовым окаймлением", располагаются т. обр., что "выступы" одной молекулы входят во "впадины" другой. Пользуясь этими представлениями, можно интерпретировать кристаллографич. данные, а в ряде случаев и предсказывать структуру молекулярных кристаллов.
Билет 6.
Химическая связь.
Образование из атомов молекул, молекулярных ионов, ионов, кристаллических, аморфных и других веществ сопровождается уменьшением энергии по сравнению с невзаимодействующими атомами. При этом минимальной энергии соответствует определенное расположение атомов друг относительно друга, которому отвечает существенное перераспределение электронной плотности. Силы, удерживающие атомы в новых образованиях, получили обобщенное название ╚химическая связь╩. Важнейшие виды химической связи: ионная, ковалентная, металлическая, водородная, межмолекулярная.
Согласно электронной теории валентности, химическая связь возникает за счет перераспределения электронов валентных орбиталей, в результате чего возникает устойчивая электронная конфигурация благородного газа (октет) за счет образования ионов (В. Коссель) или образования общих электронных пар (Г. Льюис).
Химическая связь характеризуется энергией и длиной. Мерой прочности связи служит энергия, затрачиваемая на разрушение связи, или выигрыш в энергии при образовании соединения из отдельных атомов (E св). Так, на разрыв связи H√H затрачивается 435 кДжмоль √1 , а на атомизацию метана CH 4 √ 1648 кДжмоль √1 , в этом случае E C√H = 1648: 4 = 412 кДж. Длина связи (нм) √ расстояние между ядрами в том или ином соединении. Обычно длина связи и ее энергия антибатны: чем больше длина связи, тем меньше ее энергия.
Химическая связь обычно изображается черточками, соединяющими взаимодействующие атомы; каждая черта эквивалентна обобщенной паре электронов. В соединениях, содержащих более двух атомов, важной характеристикой является валентный угол, образуемый химическими связями в молекуле и отражающий ее геометрию.
Полярность молекулы определяется разностью электроотрицательностей атомов, образующих двухцентровую связь, геометрией молекулы, а так же наличием неподеленных электронных пар, так как часть электронной плотности в молекуле может быть локализована не в направлении связей. Полярность связи выражается через ее ионную составляющую, то есть через смещение электронной пары к более электроотрицательному атому. Полярность связи может быть выражена через ее дипольный момент м, равный произведению элементарного заряда на длину диполя *) м = e l. Полярность молекулы выражается через ее дипольный момент, который равен векторной сумме всех дипольных моментов связей молекулы.
*) Диполь √ система из двух равных, но противоположных по знаку зарядов, находящихся на единичном расстоянии друг от друга. Дипольный момент измеряется в кулон-метрах (Клм) или в дебаях (D); 1D = 0,33310 √29 Клм.
Все эти факторы следует учитывать. Например, для линейной молекулы CO 2 м = 0, но для SO 2 м = 1,79 D вследствие ее углового строения. Дипольные моменты NF 3 и NH 3 при одинаковой гибридизации атома азота (sp 3), примерно одинаковой полярности связей N√F и N√H (ОЭО N = 3; ОЭО F = 4; ОЭО H = 2,1) и сходной геометрии молекул существенно различаются, поскольку дипольный момент неподеленной пары электронов азота при векторном сложении в случае NH 3 увеличивает м молекулы, а в случае NF 3 уменьшает его.
Энергией ионизации (Е ион) называется энергия, затрачиваемая на отрыв электрона от атома и превращение атома в положительно заряженный ион .
Экспериментально ионизацию атомов проводят в электрическом поле, измеряя разность потенциалов, при которой происходит ионизация. Эта разность потенциалов называется ионизационным потенциалом (J). Единицей измерения ионизационного потенциала является эВ/атом, а энергии ионизации – кДж/моль; переход от одной величины к другой осуществляется по соотношению:
Е ион = 96,5·J
Отрыв от атома первого электрона характеризуется первым ионизационным потенциалом (J 1), второго – вторым (J 2) и т.д. Последовательные потенциалы ионизации возрастают (табл. 1), так как каждый следующий электрон необходимо отрывать от иона с возрастающим на единицу положительным зарядом. Из табл. 1 видно, что у лития резкое увеличение ионизационного потенциала наблюдается для J 2 , у бериллия – для J 3 , у бора – для J 4 и т.д. Резкое увеличение J происходит тогда, когда заканчивается отрыв внешних электронов и следующий электрон находится на предвнешнем энергетическом уровне.
Т а б л и ц а 1
Потенциалы ионизации атомов (эВ/атом) элементов второго периода
| Элемент | J 1 | J 2 | J 3 | J 4 | J 5 | J 6 | J 7 | J 8 |
| Литий | 5,39 | 75,6 | 122,4 | – | – | – | – | – |
| Бериллий | 9,32 | 18,2 | 158,3 | 217,7 | – | – | – | – |
| Бор | 8,30 | 25,1 | 37,9 | 259,3 | 340,1 | – | – | – |
| Углерод | 11,26 | 24,4 | 47,9 | 64,5 | 392,0 | 489,8 | – | – |
| Азот | 14,53 | 29,6 | 47,5 | 77,4 | 97,9 | 551,9 | 666,8 | – |
| Кислород | 13,60 | 35,1 | 54,9 | 77,4 | 113,9 | 138,1 | 739,1 | 871,1 |
| Фтор | 17,40 | 35,0 | 62,7 | 87,2 | 114,2 | 157,1 | 185,1 | 953,6 |
| Неон | 21,60 | 41,1 | 63,0 | 97,0 | 126,3 | 157,9 |
Ионизационный потенциал является показателем «металличности» элемента: чем он меньше, тем легче отрывается электрон от атома и тем сильнее должны быть выражены металлические свойства элемента. Для элементов, с которых начинаются периоды (литий, натрий, калий и др.), первый ионизационный потенциал равен 4–5 эВ/атом, и эти элементы являются типичными металлами. У других металлов значения J 1 больше, но не более 10 эВ/атом, а у неметаллов обычно больше 10 эВ/атом: у азота 14,53 эВ/атом, кислорода 13,60 эВ/атом и т.д.
Первые ионизационные потенциалы в периодах увеличиваются, а в группах уменьшаются (рис. 14), что свидетельствует об увеличении неметаллических свойств в периодах и металлических в группах. Поэтому неметаллы находятся в правой верхней части, а металлы – в левой нижней части периодической системы. Граница между металлами и неметаллами «размыта», т.к. большинство элементов обладают амфотерными (двойственными) свойствами. Тем не менее, такую условную границу можно провести, она показана в длинной (18-клеточной) форме периодической системы, которая имеется здесь в аудитории и в справочнике.
Рис. 14. Зависимость ионизационного потенциала
от атомного номера элементов первого – пятого периодов.
Пример 10 . Ионизационный потенциал натрия равен 5,14 эВ/атом, а углерода 11,26 эВ/атом. Чему равна их энергия ионизации?
Решение. 1) Е ион (Na) = 5,14·96,5 = 496,0 кДж/моль
2) Е ион (С) = 11,26·96,5 = 1086,6 кДж/моль
ИОНИЗАЦИЯ
ИОНИЗАЦИЯ
Образование положит. и отрицат. ионов и свободных эл-нов из электрически нейтральных атомов и молекул. Термином «И.» обозначают как элементарный акт (И. атома, ), так и совокупность множества таких актов (И. газа, жидкости).
Ионизация в газе и жидкости. Для разделения нейтрального невозбуждённого атома (или молекулы) на две или более заряж. ч-цы, т. е. для его И., необходимо затратить энергию И. W. Для всех атомов данного элемента (или молекул данного хим. соединения), ионизующихся из основного с образованием одинаковых ионов, И. одинакова. Простейший акт И.- отщепление от атома (молекулы) одного эл-на и образование положит. иона. Свойства ч-цы по отношению к такой И. характеризуются её ионизационным потенциалом.
Присоединение эл-нов к нейтр. атомам или молекулам (образование отрицат. ионов), в отличие от др. актов И., может сопровождаться как затратой, так и выделением энергии; в последнем случае говорят, что атомы (молекулы) обладают сродством к электрону.
Если энергия И. W сообщается ионизуемой ч-це др. ч-цей (эл-ном, атомом или ионом) при их столкновении, то И. наз. ударной. Вероятность ударной И., характеризуемая т. н. сечением И. (см. ЭФФЕКТИВНОЕ), зависит от рода ионизуемых и бомбардирующих частиц и от кинетич. энергии последних Ек: до нек-рого минимального (порогового) значения Ек эта вероятность равна нулю, при увеличении Ек выше порога она вначале быстро возрастает, достигает максимума, а затем убывает (рис. 1). Если энергии, передаваемые ионизуемым ч-цам в столкновениях, достаточно велики, возможно образование из них, наряду с однозарядными, и многозарядных ионов (многократная И., рис. 2). При столкновениях атомов и ионов с атомами может происходить И. не только бомбардируемых, но и бомбардирующих ч-ц. Налетающие нейтр. атомы, теряя свои эл-ны, превращаются в ионы, а у налетающих ионов увеличивается; это явление наз. «обдиркой» пучка ч-ц. Обратный процесс - захват эл-нов от ионизуемых ч-ц налетающими положит. ионами - наз. перезарядкой ионов (см. СТОЛКНОВЕНИЯ АТОМНЫЕ).
Рис. 1. Ионизация атомов и молекул водорода электронным ударом: 1 - атомы Н; 2 - Н2 (эксперим. кривые).

Рис. 2. Ионизация аргона ионами Не+. На оси абсцисс отложена ионизирующих ч-ц. Пунктирные кривые - ионизация аргона электронным ударом.
В определ. условиях ч-цы могут ионизоваться и при столкновениях, в к-рых передаётся энергия, меньшая W: сначала атомы (молекулы) в первичных соударениях переводятся в , после чего для их И. достаточно сообщить им энергию, равную разности W и энергии возбуждения. Т. о., «накопление» необходимой для И. энергии осуществляется в неск. последоват. столкновениях. Подобная И. наз. ступенчатой. Она возможна, если столкновения происходят столь часто, что ч-ца в промежутке между двумя соударениями не успевает потерять энергию, полученную в первом из них (в достаточно плотных газах, высокоинтенсивных потоках бомбардирующих ч-ц). Кроме того, механизм ступенчатой И. очень существен в случаях, когда ч-цы ионизуемого в-ва обладают метастабилъными состояниями, т. е. способны относительно долгое сохранять энергию возбуждения.
И. может вызываться не только ч-цами, налетающими извне. При достаточно высокой темп-ре, когда энергия теплового движения атомов (молекул) велика, они могут ионизовать друг друга за счёт кинетич. энергии сталкивающихся ч-ц - происходит термическая И. Значит. интенсивности она достигает, начиная с темп-р -103-104 К, напр. в дуговом разряде, ударных волнах, в звёздных атмосферах. Степень термич. И. газа как ф-ция его темп-ры и давления оценивается Саха формулой для слабоионизованного газа в состоянии термодинамич. равновесия.
Процессы, в к-рых ионизуемые ч-цы получают энергию И. от фотонов (квантов эл.-магн. излучения), наз. фотоионизацией. Если (молекула) не возбуждён, то энергия ионизующего фотона hn (n - частота излучения) в прямом акте И. должна быть не меньше энергии И. W. Для всех атомов и молекул газов и жидкостей W такова, что этому условию удовлетворяют лишь фотоны УФ и ещё более коротковолнового излучения. Однако фотоионизацию наблюдают и при hn
Если разность hn-W относительно невелика, то поглощается в акте И. Фотоны больших энергий (рентгеновские, g-кванты), затрачивают при И. часть своей энергии (изменяя свою частоту). Такие фотоны, проходя через в-во, могут вызвать значит. число актов фотоионизации. Разность DE-W (или hn-W при поглощении фотона) превращается в кинетич. энергию продуктов И., в частности свободных эл-нов, к-рые могут совершать вторичные акты И. (уже ударной).
Большой интерес представляет И. лазерным излучением. Его частота обычно недостаточна для того, чтобы одного фотона вызвало И. Однако чрезвычайно высокая потока фотонов в лазерном пучке делает возможной И., обусловленную одновременным поглощением неск. фотонов (многофотонная И.). Экспериментально в разреженных парах щелочных металлов наблюдалась И. с поглощением 7-9 фотонов. В более плотных газах И. лазерным излучением происходит комбиниров. образом. Сначала многофотонная И. освобождает неск. «затравочных» эл-нов. Они разгоняются полем световой , ударно возбуждают атомы, к-рые затем ионизуются светом (см. СВЕТОВОЙ ПРОБОЙ). Фотоионизация играет существ. роль, напр., в процессах И. верхних слоев атмосферы, в образовании стримеров при электрич. пробое газа.
И. атомов и молекул газа под действием сильных электрич. полей (=107 -108 В*см-1), наз. автоионизацией, используется в ионном проекторе и электронном проекторе.
Ионизованные газы и жидкости обладают электропроводностью, что, с одной стороны, лежит в основе их разл. применений, а с другой - даёт возможность измерять степень И. этих сред, т. е. отношение концентрации заряж. ч-ц в них к исходной концентрации нейтр. ч-ц.
Физический энциклопедический словарь. - М.: Советская энциклопедия . . 1983 .
ИОНИЗАЦИЯ
Превращение электрически нейтральных атомных частиц (атомов, молекул) в результате превращения из них одного или неск. электронов в поло ионы и свободные электроны. Ионизовываться могут также и ионы, что приводит к повышению крат их заряда. (Нейтральные атомы и молекулы мо особых случаях и присоединять электроны, об отрицательные ионы.
)Термином "И." обозна как элементарный акт (И. атома, молекулы), исовокупность множества таких актов (И. газа, фотоионизация); ионизация полем;
И. при взаимодействии с поверхностыо твёрдого тела ( поверхностная ионизация);
ниже рассматриваются первые два типа И. Столкновнтельная ионизация
является важнейшим механизмом И. в газах и плазме. Элементарный акт И. характеризуется эфф. сечением ионизации s i [см 2 ], зависящим от сорта сталкивающихся частиц, их квантовых состояний и скорости относительного движения. При анализе кинетики И. используются понятия скорости И. <v
s i (v
)>, характеризующей число ионизации, к-рое может произвести одна ионизующая частица в 1 с:
Здесь v
- скорость относит, движения и F (v) -
ф-ция распределения по скоростям ионизующих частиц. Вероятность ионизации w
i данного атома (молекулы) в единицу времени при плотности N
числа ионизующих частиц связана со скоростью И. соотношением Определяющую роль в газах и плазме играет И. электронным ударом (столкновения со сводными 
Рис. 1. Ионизация атомов и молекул водорода электронным ударом; 1 -
атомы Н; 2 -
молекулы Н 2 (экспериментальные кривые); 3 -
атомы Н (теоретический расчёт, Борна); 4 -
расчёт
электронами). Доминирующим процессом является одноэлектронная И.- удаление из атома одного (обычно внеш.) электрона. Кинетич. энергия ионизующего электрона при этом должна быть больше или равна энергии связи электрона в атоме. Мин. значение кинетич. энергии ионизующего электрона наз. порогом (границей) ионизации. Сечение И. атомов, молекул и ионов электронным ударом равно нулю в пороге, возрастает (приблизительно по линейному закону) с ростом кинетич. энергии, достигает макс, значения при энергиях, равных нескольким (2-5) пороговым значениям, автоионизационных состояний либо И. внутр. оболочек атома. Последние можно рассматривать независимо, поскольку их вклад в И. связан с др. электронными оболочками атома.
Рис. 2. Ионизация атомов Zn электронным ударом вблизи порога.
Наряду с одноэлсктронпои И. возможно удаление двух и более электронов в одном акте столкновения при условии, что кинетич. энергия больше или равна соответствующей энергии И. Сечение этих процессов в неск. раз (для двух- и трёхэлектронных) или на неск. порядков величины (для многоэлектронных процессов) меньше сечений одноэлектронной И. Поэтому в кинетике И. газов и плазмы осн. роль играют процессы одноэлектронной И. п одноэлектронного возбуждения автоионизац. состояний.
где а 0 =0,529.10 -8 см - Бора радиус; R
=13,6 эВ -т. н. ридбергова единица энергии, равная энергии И. атома водорода из осн. состояния (см. Ридберга постоянная);
E i -
энергия И. рассматриваемого состояния атома или иона; n l -
число эквивалентных электронов в оболочке атома; l
- значение орбитального момента нач. состояния электрона; величина u=(E-E i
)/E i
есть разность кинетич. энергии налетающего электрона Eи порога ионизации E i
, выраженная в единицах E i
. Ф-ции Ф(u)вычислены и табулированы для большого количества атомов и ионов в . При больших энергиях налетающего электрона EдE i
применяется возмущений теория
первого порядка (т. н. борновское приближение).
В этом случае для И. атома водорода из осн. состояния ф-ция
В областях малых и средних энергии налетающего электрона (uхl) важнейшим эффектом, влияющим на величину s i
, является эффект обмена, связанный с тождественностью налетающего и выбитого из атома электронов . Расчёт s i
одноэлектронной И. в рамках теории возмущений с учётом эффекта обмена приводит к удовлетворит, согласию с экспериментом для большинства атомов и ионов .Усовершенствование (и усложнение) методов расчёта позволяет описать детальную структуру ионизац. кривых, а также освободившихся электронов по энергии и углу рассеяния (т. и. дифференц. сечения).Указанная выше скорость И. (1) в предположении максвелловского распределения электронов по скоростям может быть представлена в виде
где b=
E i /kT, T -
темп-pa ионизующих электронов. Ф-ции G(b) вычислены и табулированы в для большого числа атомов и ионов. Как видно из формул (2)и (4), с повышением заряда иона Z
() И. убывает пропорц. Z
-4 ,
аскорость И.С повышением энергии налетающего электрона энергетически возможно выбивание одного из электронов 
Рис. 3. Ионизации атома водорода протонами: 1 -
экспериментальные данные; 2 -
расчёт в приближении Борна; 3 -
расчёт .
внутр. оболочек ( К, L, . ..
)многоэлектронных атомов (или ионов). Соответствующие течения и скорости И. описываются также ф-лами (2) и (4). Однако создание вакансии во внутр. оболочке приводит к образованию автоионизац. состояния атома, к-рое неустойчиво и распадается с удалением из атома одного или неск. электронов и излучением фотонов (оже-эффект).
Но сечения этого процесса много меньше сечения И. внеш. оболочки, поэтому в плазме доминирующим механизмом образования многозарядных ионов является последовательная И. внеш. оболочек.
В плотных газах и при высокоинтенсивных потоках бомбардирующих частиц, обладающих кинетич. энергией 
Рис. 5. Ионизация молекулярного водорода атомами водорода (кривая 1)и протонами (кривая 2).
И. атомов и молекул в столкновениях с нейтральными атомами объясняется теми же механизмами, что и в столкновениях с ионами, однако, как правило, количественно менее эффективна. На рис. 5 приведены для сравнения ионизац. кривые для ионизации молекулярного водорода атомами водорода и протонами. перезарядка ионов."Квазимолекулярный" характер процессов столкновений атомных частиц при малых скоростях может приводить к более эффективному, чем в электронных столкновениях (при тех же скоростях), образованию ионов с зарядом больше единицы. Диагностика плазмы).
При этом необходимо иметь надёжные данные о темп-ре (ф-ции распределения) частиц и их плотности. Этот метод успешно применяется для исследования И. многозарядных (Zа10) ионов электронным ударом. Ионизация светом (фотоионизация)
- процесс И. атомных частиц в результате поглощения фотонов. В слабых световых полях происходит однофотонная И. В световых полях высокой интенсивности возможна многофотонная ионизация.
Напр., частота лазерного излучения обычно недостаточна для того, чтобы поглощение одного фотона вызвало И. Однако чрезвычайно высокая плотность потока фотонов в лазерном пучке делает возможной многофотонную И. Экспериментально в разреженных парах щелочных металлов наблюдалась И. с поглощением 7-9 фотонов.
где a= 1 / 137 - тонкой структуры постоянная,
w г - граничная чистота фотоионизации, w - частота фотона и ![]() . Для атома водорода w г =109678,758 см -1 (l@1216 Е). (В спектроскопии частота часто даётся в "обратных" см, т. е. ~1/l.) Вблизи границы фотоионизации (w-w г Ъw г)
. Для атома водорода w г =109678,758 см -1 (l@1216 Е). (В спектроскопии частота часто даётся в "обратных" см, т. е. ~1/l.) Вблизи границы фотоионизации (w-w г Ъw г)
вдали от границы (w-w г дw г)
Сечение фотоионизации из возбуждённых состояний убывает с ростом гл. квантового числа
n
пропорц. n -5 (для n/З). Сечение фотоионизации s ф связано с коэф.
Рис. 6. Фотоионизация атомов щелочных металлов: лития(1 -
эксперимент; 2 -
расчёт) и натрия (3 -
эксперимент;4 -
расчёт).
фотопоглощения фотона фиксированной частоты следующим образом:
Здесь сумма берётся по всем уровням атома, для к-рых энергетически возможна , и N n -
плотность числа атомов в состоянии n.
Вычисление сечений и сопоставление с эксперим. данными (в т. ч. и дляневодородоподобных атомов) приведены в . Сечение фотоионизации на 2-3 порядка ниже s i
при столкновениях. Z имеет смысл эфф. заряда остова, в поле к-рого движется ). Фотоионизация глубоких внутр. оболочек атомов, в отличие от И. электронным ударом, практически нe влияет на электроны внеш. оболочек, т. е. является весьма селективным процессом. Оже-эффект, сопровождающий ликвидацию вакансии во внутр. оболочке, приводит к образованию многозарядного иона. При этом могут образоваться ионы неск. степеней кратности. В табл. даны вычисленные и наблюдаемые значения ср. зарядов ионов для нек-рых атомов.
Т а б л. - Вычисленные и наблюдаемые значения средних зарядов ионов

Экспериментально фотоионизация исследуется по измерению коэф. поглощения, регистрации числа образовавшихся ионов, измерению рекомбинац. излучения (сечения обратного процесса - фоторекомбинации). Фотоионизация играет существенную роль в ионизацонном балансе верхних слоев атмосферы, планетарных туманностей, подверженных ионизующему излучению звёзд и др. плазму. Процессом, обратным И., является рекомбинация ионов и электронов,
связанная с ионизац. процессами соотношениями, следующими из принципов детального равновесия. Процессы И. и рекомбинации играют важную роль во всех электрич. разрядах в газах и разл. газоразрядных приборах. Лит.:
1) Донец Е. Д., Овсянников В. П., Исследование ионизации положительных ионов электронным ударом, "ЖЭТФ ", 1981, т. 80, с. 916; 2) Петеркоп Р. П. Пресняков.
Физическая энциклопедия. В 5-ти томах. - М.: Советская энциклопедия . Главный редактор А. М. Прохоров . 1988 .
Синонимы :
Смотреть что такое "ИОНИЗАЦИЯ" в других словарях:
ИОНИЗАЦИЯ, превращение атомов и молекул в ионы и свободные электроны; процесс, обратный рекомбинации. Ионизация в газах происходит в результате отрыва от атома или молекулы одного или нескольких электронов под влиянием внешних воздействий. В… … Современная энциклопедия
Ионизация атомов может быть прямой, косвенной или многофотонной. В первом случае атом или молекула при столкновении с фотоном поглощает его энергию и ионизуется. При этом энергия фотона должна превышать энергию ионизации. Во втором случае атом, поглотив энергию фотона, переходит в возбужденное состояние. Если время жизни в возбужденном состоянии достаточно велико, то в результате следующих актов поглощения фотонов также может произойти ионизация атома. Эти процессы можно записать следующим образом:
где обозначают нейтральный, возбужденный и ионизованный атом.
В процессе прямой ионизации должны выполняться законы сохранения энергии и импульса:

где - единичный вектор, определяющий начальное направление светового пучка, и - масса и скорость электрона, М и V - масса и скорость иона. Отделенный от атома электрон движется в направлении, противоположном движению положительного иона . С учетом этого

Значение правой части выражения (28.3) не может превысить единицу; поэтому
![]()
Первое из выражений (28.2) можно записать в виде
![]()
Это означает, что почти вся энергия кванта передается электрону.
а. Многофотолная ионизация
Наибольший интерес представляет процесс многофотонной ионизации. Его теорию разработали Бебб и Голд , Фелпс , Бункин и Прохоров , Келдыш , Делоне , Гонтье и Траин и др. Согласно классификации Делоне, многофотонная ионизация во многих случаях является прямым, резонансным или многофотонным процессом высокого порядка. В общем случае энергия нескольких или даже 10-20 фотонов не равна точно энергии ионизации. Следовательно, взаимодействие этих фотонов с атомом не может быть резонансным. Вероятность ионизации атома в течение 1 с пропорциональна степени потока фотонов (где - кратность процесса ионизации):
![]()
Здесь Пучок рубинового лазера с плотностью мощности эквивалентен потоку фотонов Величина называется эффективным поперечным сечением ионизации порядка. Например, энергия ионизации атома гелия равна 24,58 эВ; энергия одного кванта излучения рубинового лазера - лишь 1,78 эВ, следовательно только одновременное поглощение 14 квантов может обеспечить ионизацию атомов гелия. В табл. 28.2 приведены энергии ионизации некоторых атомов и молекул. Бебб и Голд рассчитали методом теории возмущений эффективные поперечные сечения для ионизации Не и Н; ионизация этих атомов требует одновременного поглощения 7, 8, 9, 13 и 14 квантов излучения рубинового лазера, соответственно. Простейшей аппроксимацией этого процесса является введение перехода дипольного типа и представление электрона, оторванного от атома, в виде плоской волны. Изложить здесь теорию Бебба и Голда невозможно ввиду ее громоздкого характера. Приведем лишь основные результаты работы , которые представлены в виде табл. 28.3. Как видно из таблицы, поперечные сечения многофотонной ионизации чрезвычайно малы. Однако следует помнить о том, что поток фотонов в
Таблица 28.2 (см. скан) Энергии ионизации некоторых атомов и молекул
Таблица 28.3 (см. скан) Эффективные поперечные сечения многофотонной ионизации и пороговые потоки фотонов, необходимые для инициирования пробоя и рассчитанные для плотности газа и воздействия лазерного импульса длительностью 10 нс на объем газа
лазерном пучке может достигать весьма высоких значений. Экспериментальная проверка формулы (28.5) очень; проста. Отложив по осям координат получим прямую, наклон которой определяет
Процесс многофотонной ионизации можно описать теоретически и без помощи теории возмущений и др.). В этом методе, который часто называют методом Рейсса, учитываются лишь два состояния электрона - начальное и конечное. Если под конечным состоянием понимать ионизованный атом, что соответствует изменению энергии электрона от определенного значения до континуума, можно рассчитать эффективные поперечные сечения многофотонной ионизации для многих водородоподобных атомов. Это облегчило расчет зависимости эффективных поперечных сечений от состояния поляризации света ( и др.), результаты которого нашли экспериментальное подтверждение в работах Кагана и др. , Фокса и др. и Сервенана и Айсенора . Теоретические расчеты показывают, что при вероятность ионизации атомов существенно зависит от состояния поляризации света. При более эффективен свет с круговой поляризацией, чем с линейной. При более эффективным становится свет с линейной поляризацией. Для иллюстрации на рис. 28.15 приведен график зависимости от порядка процесса (при ).
Каган и др. наблюдали ионизацию паров цезия второй гармоникой рубинового лазера. Процесс был двухфотонным. Установлено, что эффективность ионизации излучением с круговой

Рис. 28.15. Отношение эффективных поперечных сечений многофотонной ионизации для излучения с круговой и линейной поляризацией в зависимости от числа одновременно поглощаемых квантов излучения неодимового лазера .
поляризацией была в раза выше, чем для линейно-поляризованного излучения. Вскоре Фокс и др. сообщили о трехфотонной ионизации атомов цезия пучком рубинового лазера, при которой свет с круговой поляризацией в два раза эффективнее, чем с линейной. Кроме того, расчеты без применения теории возмущений показали, что зависимость вероятности многофотонной ионизации от потока фотонов может иметь максимумы и минимумы. Особую роль в процессе многофотонной ионизации играет резонансный эффект. Он возникает, когда суммарная энергия нескольких фотонов точно равна энергии электрона в одном из возбужденных состояний. Таким образом, процесс ионизации может быть двухступенчатым. Вначале электрон переходит в возбужденное состояние, а затем полностью отрывается от атома. В исследования резонансных эффектов внесли значительный вклад Делоне и др. , Эванс и Тонеманн и Хелд и др. .