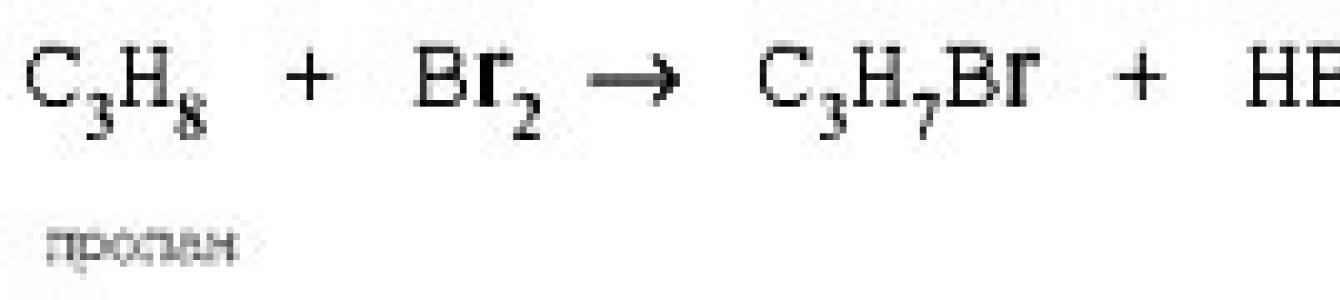Тесты по химии к аттестации школы
Окончание. Начало см. в № 3/2006
* «Звездочка» означает к о м м е н т а р и и: какие контролируются знания и умения, решения заданий.
Тесты, предлагаемые в 1-м и 2-м полугодиях, различаются по охватываемому материалу школьной программы. Мы рассматриваем задания, рассчитанные на начало учебного года. Здесь проверяются знания учащихся по предыдущему году обучения. Например, в 11-м классе большинство вопросов (10 из 15) посвящены органической химии. Во 2-м полугодии в задания тестов войдут вопросы, изученные в 1-м полугодии текущего года обучения.
Что же надо знать учащимся 11-го класса при выполнении данного теста? Это понятия «функциональная группа», «гомологи», «изомеры»; названия и химические формулы десяти линейных алканов: метана СН 4 , этана С 2 Н 6 , пропана С 3 Н 8 и т. д; тривиальные названия кислород- и азотсодержащих органических соединений: ацетальдегида, формальдегида, уксусной кислоты, этилового спирта, фенола, метилацетата, метиламина; химические свойства веществ; качественные реакции, например, фенола, алкенов, альдегидов, глицерина. Проверяются знания классификации неорганических соединений, в частности оксиды – кислотные, основные и амфотерные; умение пользоваться электронными формулами атомов; виды химических связей и кристаллических решеток, типы химических реакций, расчеты по уравнению реакции.
11-й класс
Вариант 1
1. Соединения, в состав которых входит функциональная группа NН 2 , относятся к классу:
1) аминов; 2) нитросоединений;
3) карбоновых кислот; 4) альдегидов.
* Функциональные группы
(определяющие
свойства всего класса веществ)
азот- и
кислородсодержащих органических соединений: а)
NН 2 – аминов;
б)
NО 2 – нитросоединений;
в)
СООН – карбоновых кислот;
г)
С(О)Н – альдегидов.
2. Гомологом этана является:
1) С 2 Н 4 ; 2) С 2 Н 6 ; 3) С 6 Н 6 ; 4) С 3 Н 8 .
* Гомологи – вещества, сходные по строению, различающиеся на одну или несколько групп СН 2 . Сходные – значит принадлежащие к одному классу веществ, например алканы. Более того, у гомологов – одинаковые цепи: либо линейные, либо разветвленные. Сначала надо по названию (этан) написать химическую формулу вещества (С 2 Н 6). Затем, складывая (С 2 Н 6 + СН 2 С 3 Н 8), получить ответ.
3. Пропан взаимодействует с:
1) бромом; 2) хлороводородом;
3) водородом; 4) гидроксидом натрия (р-р).
* Чтобы ответить на вопрос, надо знать о принадлежности пропана к алканам, а также свойства алканов. Для алканов характерны реакции свободнорадикального замещения с галогенами:
![]()
4. Этанол не взаимодействует с:
1) Сu; 2) Nа; 3) НСl; 4) О 2 .
* Проверяются знания химических свойств спиртов. В учебниках приводят свойства веществ изучаемого класса (в данном вопросе – свойства спиртов). Только ответить надо, с каким из четырех предложенных веществ этанол не взаимодействует. Реакции этанола:

Может сбить с верного пути следующая реакция:
Однако в ней участвует не медь – восстановитель, а оксид меди(II) – окислитель, хотя и слабый.
5. Этилацетат образуется при взаимодействии уксусной кислоты с:
1) ацетальдегидом; 2) этиленом;
* Этилацетат – сложный эфир – продукт взаимодействия уксусной кислоты с этиловым спиртом:

Присоединение к уксусной кислоте других реагентов, например этилена, не происходит, т. к. уксусная кислота – слабая.
6. Ацетальдегид взаимодействует с:
1) этаном; 2) водородом;
3) оксидом углерода(IV); 4) толуолом.
* Из предложенных веществ ацетальдегид реагирует только с водородом:

7. Вещество Х в схеме реакции
СН 3 СООН + СН 3 ОН Х + Н 2 О:
1) этилацетат; 2) этанол;
3) метилацетат; 4) диэтиловый эфир.
* Надо воспользоваться уравнением реакции из ответа на задание 5. Различие – в используемом спирте (вместо этанола – метанол) и в продукте реакции, здесь ответ – метилацетат.
8. Метиламин взаимодействует с:
1) метаном; 2) кислородом;
* Метиламин – газ (t кип = –42 °С), его выпускают в виде 40%-го водного раствора. Из концентрированных растворов он улетучивается, и, если поднести зажженную спичку к горлышку склянки, газ СН 3 NH 2 вспыхивает:
4СН 3 NН 2 + 9О 2 4СО 2 + 10Н 2 О + 2N 2 .
9. Непредельные углеводороды отличают от предельных с помощью:
1) H 2 SO 4 (конц.); 2) NaOH (р-р);
3) Ag 2 O; 4) KMnO 4 (р-р).
* Качественные реакции в химии связаны с выделением газа, образованием осадка и изменением окраски раствора. Непредельные углеводороды обесцвечивают розовый раствор марганцовки (происходит гидроксилирование по двойной связи). В присутствии кислоты получается бесцветный раствор, а в нейтральной среде выпадает бурый осадок MnO 2:

10. Взаимодействие растворов хлорида меди(II) и гидроксида натрия относится к реакциям:
1) соединения; 2) разложения;
3) обмена; 4) замещения.
* Уравнение реакции хлорида меди(II) и гидроксида натрия, протекающей в растворе:
CuCl 2 + 2NaOH = Cu(OH) 2 + 2NaCl.
11. Какой элемент имеет низшую степень окисления в соединении NаНSО 4 ?
1) Водород; 2) сера;
3) кислород; 4) натрий.
* Низшая степень окисления (условный заряд атома) в соединении NaHSO 4 – у атома кислорода, она равна –2. У атомов натрия, водорода и серы в NaHSO 4 положительные (и значит, большие, чем –2) степени окисления.
12. Химическая связь в молекулах фтора и метана:
* Связь между одинаковыми атомами неметалла (F–F) – ковалентная неполярная, а между атомами разных неметаллов (С–Н) – ковалентная полярная.
13. Укажите основный оксид:
1) SO 3 ; 2) FeO; 3) Al 2 O 3 ; 4) ZnO.
* Условие необходимое, но недостаточное: основный оксид – оксид металла. Поэтому исключаем оксид SO 3 . Среди трех оставшихся веществ Al 2 O 3 и ZnO – амфотерные оксиды, а FeO – основный оксид.
14. Электронная формула внешнего энергетического уровня атома бора:
1) 2s 2 2p 1 ; 2) 3s 2 3p 1 ; 3) 3s 2 3p 3 ; 4) 3s 1 .
* Бор – элемент 2-го периода таблицы Д.И.Менделеева, поэтому варианты ответа 2–4, где фигурирует 3-й энергетический уровень, отпадают.
15. Количество вещества брома Вr 2 , которое может присоединить ацетилен объемом 11,2 л (н.у.) по уравнению реакции
С 2 Н 2 + 2Вr 2 С 2 Н 2 Вr 4 ,
1) 1 моль; 2) 2 моль; 3) 0,5 моль; 4) 0,25 моль.
*Рассчитаем количество вещества ацетилена, взятого в реакцию:
(C 2 H 2) = V /V M = 11,2/22,4 = 0,5 моль.
Коэффициенты перед формулами веществ в уравнении реакции показывают количества веществ участников реакции в молях. Составим пропорцию:
1 моль С 2 Н 2 присоединяет 2 моль Br 2 ,
0,5 моль С 2 Н 2 » » х моль Br 2 .
Отсюда х = 1 моль.
Ответы
| 1
– 1, 2
– 4, 3
– 1, 4
– 1, 5
– 3, 6
– 2, 7
– 3, 8
– 2, 9
– 4, 10 – 3, 11 – 3, 12 – 3, 13 – 2, 14 – 1, 15 – 1. |
Вариант 2
1. Вещество с молекулярной формулой С 6 Н 6 относится к классу:
1) алканов; 2) аренов;
3) алкинов; 4) алкенов.
* Общие формулы углеводородов разных классов: С n H 2n +2 – алканы, С n H 2n – алкены, С n H 2n –2 – алкины, С n H 2n –6 – арены. Подставляя n = 6, находим, что индексу 6 при водороде удовлетворяет класс веществ «арены».
2. Изомерами являются:
1) этилен и ацетилен;
2) 2-метилпропан и 2-метилбутан;
3) 2-метилбутан и н -пентан;
4) н -пентан и н -бутан.
* Среди углеводородов изомеры – вещества с одинаковым числом атомов углерода, а также атомов водорода. Молекулярные формулы предложенных веществ:
1) С 2 Н 4 и С 2 Н 2 ; 2) С 4 Н 10 и С 5 Н 12 ;
3) С 5 Н 12 и С 5 Н 12 ; 4) С 5 Н 12 и С 4 Н 10 .
Отсюда видно, что верный ответ – 3.
3. При полном сгорании пропана С 3 Н 8 образуются:
1) С и Н 2 О; 2) СО 2 и Н 2 О;
3) СО и Н 2; 4) СО и Н 2 О.
* При полном сгорании углеводородов образуются углекислый газ и вода (оксиды элементов, составляющих исходный углеводород).
4. Сходство фенола и одноатомных спиртов проявляется во взаимодействии с:
1) NаОН (р-р); 2) Nа;
3) НСl; 4) НNО 3 (р-р).
* И фенол, и спирт реагируют с натрием:

5. Бутилацетат образуется при взаимодействии бутанола с:
1) ацетальдегидом; 2) уксусной кислотой;
3) этиловым спиртом; 4) ацетиленом.
* Проверяется знание реакции этерификации, а вместе с тем – номенклатуры сложных эфиров («бутилацетат»). Уравнение реакции:
6. Формальдегид взаимодействует с:
1) метаном; 2) кислородом;
3) гидроксидом кальция; 4) бензолом.
* Некоторую сумятицу в этот вопрос вносят сведения о первом синтезе сахаристых веществ действием гидроксида кальция на формальдегид (А.М.Бутлеров, 1861 г.):
![]()
Выбрать следует окисление формальдегида кислородом:

7. Уксусная кислота может реагировать с каждым веществом пары:
1) метанол и серебро;
2) гидроксид меди(II) и метанол;
3) серебро и гидроксид меди(II);
4) магний и метан.
* Три вещества: метанол, серебро и гидроксид меди(II) – повторяются попарно в разных сочетаниях. Надо вспомнить ряд напряжений металлов и положение в нем серебра (правее водорода). Серебро с уксусной кислотой не реагирует, варианты 1 и 3 исключаем. Метан из варианта ответа 4 тоже инертное вещество по отношению к СН 3 СООН. Выбираем ответ 2:
2СН 3 СООН + Сu(ОН) 2 (СН 3 СОО) 2 Сu + 2Н 2 О,
СН 3 СООН + СН 3 ОН СН 3 СООСН 3 + Н 2 О.
8. Этиламин может реагировать с:
1) KOH и HNO 3 ; 2) H 2 SO 4 и O 2 ;
3) NaOH и CH 3 OH; 4) NaCl и O 2 .
* Амины проявляют свойства оснований и реагируют с кислотами. Напротив, с основаниями амины не реагируют, поэтому исключаем варианты ответа 1 и 3. Кстати, СН 3 ОН тоже не взаимодействует с этиламином. Амины горят (+О 2), а с солью NaCl не реагируют, как и любое другое органическое вещество. Верный выбор описывается уравнениями реакций:

9. Глицерин в водном растворе можно обнаружить с помощью:
1) хлорной извести; 2) хлорида железа(III);
3) гидроксида меди(II); 4) гидроксида натрия.
* Качественная реакция на глицерин – образование ярко-синего глицерата меди(II) при взаимодействии с гидроксидом меди(II):

10. Взаимодействие магния с соляной кислотой относится к реакциям:
1) соединения; 2) разложения;
3) обмена; 4) замещения.
* Это – замещение. Уравнение реакции:
Mg + 2HCl = MgCl 2 + H 2 .
11. Атомную кристаллическую решетку имеет вещество:
1) вода; 2) озон; 3) графит; 4) аммиак.
* Атомную кристаллическую решетку имеет графит. Прочность связей многих атомов углерода одинаково высокая. В веществах молекулярного строения (Н 2 О, О 3 , NH 3) связи внутри молекулы прочные, а между молекулами – слабые.
12. Химическая связь в молекулах воды и водорода:
1) ковалентная полярная и ковалентная неполярная;
2) ионная и ковалентная полярная;
3) ковалентная неполярная и ковалентная полярная;
4) ионная и ковалентная неполярная.
* В задании упомянуты вещества с ковалентной связью, о чем свидетельствует выражение «в молекулах». Вода – полярное соединение, водород – неполярное.
13. Укажите кислотный оксид:
1) оксид магния; 2) оксид цинка;
3) Cr 2 O 3 ; 4) СО 2 .
* Кислотный оксид – СО 2 . Ему соответствует угольная кислота Н 2 СО 3 .
14. Электронная формула внешнего энергетического уровня (n ) атомов элементов Vа группы (главной подгруппы):
1) ns 2 np 1 ; 2) ns 2 np 2 ; 3) ns 2 np 3 ; 4) ns 2 np 5 .
* Сумма индексов при обозначениях энергетических подуровней n-го уровня для элементов Vа группы равна пяти. Единственно возможное сочетание: ns 2 np 3 .
15. Масса брома, взаимодействующего с 140 г этилена по уравнению реакции
С 2 Н 4 + Вr 2 С 2 Н 4 Вr 2 ,
1) 400 г; 2) 140 г; 3) 800 г; 4) 80 г.
* Уравнение реакции бромирования этилена:

Через х обозначена искомая масса брома. Коэффициенты перед исходными веществами одинаковы, поэтому (Вr 2) = (С 2 Н 4) = m /М = 140/28 = 5 моль. Соответственно масса брома:
m(Вr 2) = М = 5 160 = 800 г.
Ответы
| 1
– 2, 2
– 3, 3
– 2, 4
– 2, 5
– 2, 6
– 2, 7
– 2, 8 – 2, 9 – 3, 10 – 4, 11 – 3, 12 – 1, 13 – 4, 14 – 3, 15 – 3. |
УКСУСНЫЙ АЛЬДЕГИД (ацетальдегид, этаналь ) - алифатический альдегид, CH 3 CHO; метаболит, образующийся при спиртовом брожении, окислении этилового спирта, в т. ч. в организме человека, и в других обменных реакциях. У. а. используют при получении различных лекарственных средств (см.), уксусной кислоты (см.), надуксусной к-ты CH 3 COOOH, уксусного ангидрида (CH 3 CO) 2 O, этилацетата, а также в производстве синтетических смол и др. На соответствующих производствах представляет собой профессиональную вредность.
У. а. представляет собой бесцветную жидкость с резким запахом, t° пл -123,5°, t° кип 20,2°, его относительная плотность при 20° 0,783, коэффициент преломления при 20° 1,3316, концентрационные пределы взрываемости (КПВ) 3,97 - 57%. С водой, этиловым спиртом, эфиром и другими органическими растворителями У. а. смешивается в любых соотношениях.
У. а. вступает во все реакции, характерные для альдегидов (см.), в частности он окисляется до уксусной к-ты, претерпевает альдольную и кротоновую конденсации, образует уксусно-этиловый эфир по реакции Тищенко и характерные для альдегидов производные по карбонильной группе. В присутствии кислот У. а. полимеризуется до циклического кристаллического тетрамера метальдегида или жидкого паральдегида. В промышленном масштабе У. а. получают гидратацией ацетилена (см.) в присутствии катализаторов - солей ртути, окислением этилового спирта (см.) и наиболее экономичным способом - окислением этилена (см. Углеводороды) в присутствии палладиевого катализатора.
Качественное обнаружение У. а. основано на появлении синего окрашивания в результате взаимодействия У. а. с нитропруссидом натрия в присутствии аминов. Количественное определение состоит в получении какого-либо производного У. а. по карбонильной группе и его весового, объемного (см. Титриметрический анализ) или колориметрического определения (см. Колориметрия).
Образование У. а. как промежуточного продукта обмена веществ происходит как в растительных, так и в животных организмах. Первой стадией превращения этилового спирта в организме человека и животных является его окисление до У. а. в присутствии алкоголь-дегидрогеназы (см.). У. а. образуется также при декарбоксилировании (см.) пирувата (см. Пировиноградная кислота) при спиртовом брожении и при расщеплении треонина (см.) под действием треонин-альдолазы (КФ 4.1.2.5). В организме человека У. а. окисляется до уксусной к-ты гл. обр. в печени под действием НАД-зависимой альдегидоксидазы (КФ 1.2.3. 1), ацетальдегидооксидазы и ксантокиназы. У. а. участвует в биосинтезе треонина из глицина (см.). В наркол. практике применение те ту рама (см.) основано на способности этого препарата специфически блокировать ацетальдегид-оксидазу, что приводит к накоплению в крови У. а. и, как следствие, к сильной вегетативной реакции - расширению периферических сосудов, сердцебиению, головной боли, удушью, тошноте.
Уксусный альдегид как профессиональная вредность
При хрон. воздействии на человека невысоких концентраций паров У. а. отмечают преходящее раздражение слизистых оболочек верхних дыхательных путей и конъюнктивы. Пары У. а. во вдыхаемом воздухе в высоких концентрациях вызывают учащение пульса, повышенную потливость; признаки резкого раздражающего действия паров У. а. в этих случаях усиливаются (особенно ночью) и могут сочетаться с удушьем, сухим болезненным кашлем, головной болью. Последствием такого отравления бывают бронхит и пневмония.
Попадание на кожу жидкого У. а. может вызывать ее гиперемию и появление инфильтратов.
Первая помощь и неотложная терапия
При отравлении парами У. а. пострадавшего необходимо вывести на свежий воздух, обеспечить ингаляцию водяного пара с нашатырным спиртом, при показаниях - ингаляции увлажненного кислорода, сердечные средства, стимуляторы дыхания (лобелин, цитотон), настойка валерианы, препараты брома. При резком раздражении слизистых оболочек дыхательных путей - щелочные или масляные ингаляции. При болезненном кашле - кодеин, этил-морфина гидрохлорид (дионин), горчичники, банки. При раздражении конъюнктивы - обильное промывание глаз водой или изотоническим р-ром хлорида натрия. При отравлении через рот - немедленное промывание желудка водой с добавлением р-ра аммиака (нашатырного спирта), 3% р-ром гидрокарбоната натрия. Дальнейшее лечение - симптоматическое. При попадании У. а. на кожу - немедленное обмывание пораженного участка водой, но лучше 5% р-ром нашатырного спирта.
Пострадавший должен быть отстранен от работы с вредными веществами до выздоровления (см. Профессиональные болезни).
Меры профилактики интоксикаций У. а. заключаются в герметизации оборудования, безотказной работе вентиляции (см.), механизации и автоматизации работ по розливу и транспортировке У. а. Хранить У. а. необходимо в герметически закупоренных сосудах. На производствах и в лабораториях, связанных с контактом с У. а., должны неукоснительно соблюдаться меры личной гигиены, пользование специальной одеждой и обувью, защитными очками, универсальными респираторами.
Предельно допустимая концентрация паров У. а. в воздухе рабочей зоны 5 мг/м 3 .
Библиогр.: Вредные вещества в промышленности, под ред. Н. В. Лазарева и Э. Н. Левиной, т. 1, Л., 1976; Лебедев Н. Н. Химия и технология основного органического и нефтехимического синтеза, М., 1981; Уайт А. и др. Основы биохимии, пер. с англ., т. 1-3, М., 1981,
А. Н. Климов, Д. В. Иоффе; Н. Г. Будковская (гиг.).,
Введение
На сегодняшний день известны миллионы химических соединений. И большинство из них относится к органическим. Эти вещества делят на несколько больших групп, название одной из них - альдегиды. Сегодня мы рассмотрим представителя этого класса - уксусный альдегид.
Определение
Уксусный альдегид является органическим соединением класса альдегидов. Его могут называть и по-другому: ацетальдегидом, этаналем или метилформальдегидом. Формула уксусного альдегида - CH 3 -CHO.
Свойства


Получение
В основном уксусный альдегид получают с помощью окисления этилена (процесс Вакера). В роли окислителя выступает хлорид палладия. Еще данное вещество можно получить во время гидратации ацетилена, в которой присутствуют соли ртути. Продуктом реакции является енол, который изомеризуется в искомое вещество. Еще один способ получения уксусного альдегида, который был наиболее популярным задолго до того, как стал известен процесс Вакера, - окисление или дегидратация этанола в присутствии медного или серебряного катализаторов. При дегидратации, помимо искомого вещества, образуется водород, а во время окисления - вода.
Применение
С помощью обсуждаемого соединения получают бутадиен, альдегидные полимеры и некоторые органические вещества, в том числе и одноименную кислоту. Она образуется при его окислении. Реакция выглядит так: "кислород + уксусный альдегид = уксусная кислота". Этаналь - важный прекурсор ко многим производным, и это свойство широко применяется в синтезе
многих веществ. В организмах человека, животных и растений ацетальдегид является участником некоторых сложных реакций. Также он входит в состав сигаретного дыма.
Заключение
Ацетальдегид может приносить как пользу, так и вред. Он плохо воздействует на кожу, является ирритантом и, возможно, канцерогеном. Поэтому его присутствие в организме нежелательно. Но некоторые люди сами провоцируют появление ацетальдегида, куря сигареты и употребляя алкоголь. Подумайте над этим!
АЦЕТАЛЬДЕГИД , СН 3 . СН: О, уксусный альдегид, находится в сыром древесном и винном спирте, в вине, во многих эфирных маслах (камфарном, анисовом, мятном и других), а также в молодых плодах гороха. А. является одним из продуктов, промежуточно образующихся в процессе спиртового брожения углеводов (см. Брожение). Его образование связано с действием кар-боксилазы-особого фермента,находящегося в зимазе дрожжей, которая разлагает пиро-виноградную кислоту (см.) на А. и углекислоту: СН, . СО. СООН=СН, . СНО + С0 2 . В результате дальнейших восстановительно-окислительных взаимодействий А. превращается в этиловый спирт. А. является также промежуточным продуктом распада глюкозы в организме животных. А. получается 1) окислением этилового алкоголя хромовой кислотой, перекисью марганца и серной кислотой или при помощи катализаторов (медь, серебро, платина): СН 3 . CH s OH+ + 0=СН э. СНО+Н а О; 2) гидратацией. А.- летучая бесцветная жидкость, обладающая в слабых разведениях приятным запахом; точка кипения 21°, уд. в. 0,7951; с водой, спиртом, эфиром А. смешивается в любых соотношениях; из водных растворов выделяется хлористым кальцием. Из химических свойств А. важны следующие. 1. Прибавление небольшого количества концентрированной серной кислоты вызывает образование паральдегида-жидкости, кипящей при 124°, не обнаруживающей типичных альдегидных реакций. Полимеризация протекает со значительным выделением тепла по уравнению: ЗСН 8 . CHO=C e H a O s . При нагревании паральдегида с кислотами наступает деполимеризация,т. е. получается обратно А. 2. В присутствии нек-рых веществ (НС1, хлористого цинка и, особенно, слабых щелочей) А. превращается в альдоли (см.): 2СН 3 . СНО = СН 3 . СН(ОН) . СН а. СНО. При действии на А. крепких щелочей образуется альдегидная смола. 3. При окислении из А. получается уксусная кислота; СНз СНО+0 = СН 3 . СООН. 4. При восстановлении образуется этиловый алкоголь: СН 3 . СНО + Н 2 =СН 3 . СН 2 ОН. 5. Синильная кислота присоединяется к А., образуя нитрил молочной кислоты: СН 3 . СНО + + HCN=CH 3 . СН(ОН) . CN, из которого омылением может быть получена молочная кислота (см.). 6. С цианистым аммонием получается амино-нитрил СН 3 ■ CH(NH 2) . CN, при омылении которого образуется ала- HUH (СМ.)- С. Медведей.Смотрите также:
- АЦЕТАТЫ , соли уксусной кислоты, в лабораторной практике применяются для изготовления буферных растворов. Введенные в организм, А., подобно другим солям жирных кислот, окисляются до углекислых солей, вызывая повышение щелочности крови и...
- АЦЕТИЛЕН , имеет химич. формулу С2Н2 (формула строения НС СН) и представляет собой при обыкновенных условиях бесцветный ядовитый газ, при 0° и 26 атм. сгущающийся в жидкость. 1 л А. ...
- АЦЕТОЗОН , бензозон, С6Н6С0.02.СОСН„ перекись бензоил-ацетила, белый кристал-лич. порошок, плав, при 40°, растворяющийся в воде; водные растворы, подобно перекиси водорода, являются сильными окислителями; щелочами и органическими веществами ацетозон разлагается; при нагревании...
- АЦЕТОМЕТР (от лат. acetum - уксус и греч. metron -мера), прибор, изобретенный Отто для определения количества свободной уксусной кислоты в уксусе в тех случаях, когда не предполагается присутствия посторонних кислот и...
- АЦЕТОН , CH3-CO-CH3 (диметилкетон), бесцветная, воспламеняющаяся жидкость с удельным весом 0,79 при 18°, с приятным запахом, жгучего вкуса. Кипит при 56,5°, легко растворяется в воде, в алкоголе и эфире. Ацетон получается...
Ацетальдегид (этаналь, уксусный альдегид) СН 3 СНО представляет бесцветную легкокипящую жидкость с резким удушливым запахом, с температурой кипения 20,2 о С, температурой плавления –123,5 о С и плотностью 0,783 т/м3. Критическая температура ацетальдегида 188 о С, температура воспламенения 156 о С. В воздухом ацетальдегид образует взрывчатые смеси с пределами воспламеняемости при 400 о С 3,97 и 57% об. Смеси с кислородом воспламеняются при более низкой температуре – около 140 о С. Токсичен, ПДК составляет 5 мг/м3.
Ацетальдегид смешивается во всех отношениях с водой, этанолом, диэтиловым эфиром и другими органическими растворителями, с некоторыми образует азеотропные смеси.
Ацетальдегид – соединение, в молекуле которого карбонильная группа связана с углеводородным радикалом и атомом водорода (СН 3 – СН=О). Ацетальдегид не образует водородных связей, поэтому температура его кипения значительно ниже, чем у соответствующих спиртов.
1.1.1 Физические свойства ацетилена
Ацетилен (этин) C2H2 – это бесцветный газ, обладающий в чистом виде слабым эфирным запахом, с температурой кипения –83,8оС, температурой плавления –80,8оС (при 0,17 МПа) и плотностью 1,09 кг/м3. Критическая температура ацетилена 35,5оС.
При нагревании до 500оС и при сжатии до давлений выше 2*105 Па ацетилен, даже в присутствии кислорода, разлагается со взрывом. Разложение инициируется искрой и трением. Взрывоопасность ацетилена возрастает в контакте с металлами, способными образовывать ацетилениды, например, с медью. Это необходимо учитывать при выборе материала аппаратуры. С воздухом ацетилен образует взрывчатые смеси с пределами воспламенения 2,3 и 80,7 % об. При этом взрывоопасность смесей снижается при разбавлении их инертными газами (азот, метан) или парами.
Ацетилен значительно лучше, чем другие газообразные углеводороды, растворим в воде. При температуре 15оС и давлении 105 Па в одном объеме воды растворяется 1,15 объемов. В других растворителях растворимость ацетилена составляет: в ацетоне 25, этаноле 6, бензоле 4, уксусной кислоте 6 объемов. Растворимость в ацетоне возрастает с повышением давления и при 1,25 МПа составляет уже 300 объемов в одном объеме. Растворимость ацетилена в различных растворителях имеет большое значение для его выделения из смесей с другими газами, а также при хранении в баллонах в виде раствора и в ацетоне.
Ацетилен является эндотермическим соединением с энтальпией образования +227,4 кДж/моль. Поэтому при сгорании его в кислороде выделяется большое количество тепла и развивается высокая температура, достигающая 3150оС.
1.2. Химические свойства
1. Под воздействием минеральных кислот ацетальдегид полимеризуется с образованием жидкого циклического тримера – паральдегида с температурой кипения 124,4оС и температурой плавления 12,6оС:
3СН 3 СНО СН 3 СН – О- СН(СН 3)- О- СН(СН 3)-О
ацетальдегид тример-паральдегид
и кристаллического тетрамера – метальдегида:
4СН 3 СНО(СН 3 СНО) 4 ,
ацетальдегид тетрамер-метальдегид
которые при нагревании с серной кислотой деполимеризуются до исходного ацетальдегида. На этом основано использование во многих случаях паральдегида вместо мономерного ацетальдегида, так как он более удобен при хранении и транспортировке.
2. Присоединение циановодородной (синильной) кислоты. Ацетальдегид взаимодействуя с синильной кислотой образует оксикислоту:
СН 3 СНО+НСNСН 3 СНОН-СN
ацетальдегид синильная оксикислота
Эта реакция является реакцией нуклеофильного присоединения по двойной связи С=О, она используется для удлинения углеродной цепи и получения оксикислот
3. Гидрирование – это химический процесс, связанный с присоединением молекулы водорода к ацетальдегиду.В данной реакции присоединение водорода идет по по ненасыщенным связям с образованием этанола:
СН 3 СНО+Н 2 СН 3 СН 2 ОН
ацетальдегид этиловый спирт (этанол)
4. Реакция «серебряного зеркала» - окисление ацетальдегида аммиачным раствором оксида серебра, с образованием соли уксусной кислоты (ацетата), серебра (в виде осадка), аммиака и воды:
СН 3 СНО+2OHСН 3 СООNH 4 +2Ag+3NH 3 +H 2 O
ацетальдегид аммиачный раствор ацетат аммиак
оксида серебра
5. Окисление гидроксидом меди (II). Ацетальдегид взаимодействует с гидроксидом меди с образованием уксусной кислоты оксида меди и воды:
СН 3 СНО+2Сu(ОН) 2 СН 3 СООН+СuO+2Н 2 О
ацетальдегид гидроксид уксусная оксид
меди кислота меди
СuO – осадок красного цвета.
6. Взаимодействие со спиртами с образованием ацеталей и полуацеталей. Полуацетали – соединения, в которых атом углерода связан с гидроксильной и алкоксильной группами. Ацетали - соединения, в которых атом углерода связан с двумя алкоксильными группами:
СН 3 -СН=О+2СН 3 ОНСН 3 -СН-ОСН 3 + Н 2 О
ацетальдегид метанол
7. Присоединение гидросульфита натрия (NaHSO 3) c образованием гидросульфитных производных альдегидов:
С=О+НSO 3 Na C
гидросульфитное производное этаналя
1.2.1 Химические свойства ацетилена
В молекуле ацетилена содержатся два активных фрагмента: тройная связь -СС- и подвижный «ацетиленовый» атом водородаС-Н. В соответствии с этим реакции ацетилена могут быть сведены к двум основным типам:реакции винилирования; реакции с участием «ацетиленового» атома водорода.
1. Реакции присоединения – общие для всех алкинов. Реакция Кучерова приводит к образованию ацетальдегида:
НССН+Н 2 О[СН 2 =СН-ОН] СН 3 -СН=О.
2. Слабые кислотные свойства:
2 НССН+2Na2NaССna+H 2
НССН+2OHAgCCAg+4NH 3 +2H 2 O.
Соли ацетилена называют ацетиленидами. Ацетилениды легко разалагаются при действии соляной кислоты:
AgCCag+HClНССН+2AgCl.
3. Полимеризация:
а) димеризация под действием водного раствора CuClиNH 4 Cl:
НССН+НССНСН 2 =СН-ССН
Винилацетилен
б) тримеризация (реакция Зелинского) с образованием бензола.